题目内容
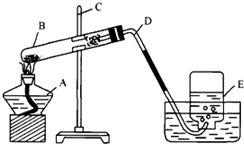
在实验室用一氧化碳还原2.0 g赤铁矿样品,反应后生成的二氧化碳跟足量的澄清石灰水反应,生成了3.0 g白色沉淀.求赤铁矿样品中Fe2O3的质量分数.
解析:
| 答案:解:设生成3.0 g碳酸钙需要二氧化碳的质量为x
CO2+Ca(OH)2===CaCO3↓+H2O 44 100 x 3.0 g x= 设生成1.32 g二氧化碳需要Fe2O3的质量为y Fe2O3+3CO 160 132 y 1.32 g y= 赤铁矿样品中Fe2O3的质量分数为 =80% 答:赤铁矿样品中Fe2O3的质量分数为80%.
|
提示: