题目内容
【题目】某同学称取一定质量的高锰酸钾制取氧气。加热一段时间后称得剩余固体为30.00g并测得剩余固体中钾元素的质量为7.80g。试计算:
(1)该同学称取的高锰酸钾的质量为多少?___
(2)反应生成氧气的质量为多少?___
(3)剩余固体物质中各物质的质量分别为多少?___
【答案】该同学称取的高锰酸钾的质量为31.6g 反应生成氧气的质量为1.6g 剩余固体物质中高锰酸钾的质量为15.8g,锰酸钾的质量为9.85g,二氧化锰的质量为4.35g。
【解析】
据质量守恒定律可知,反应前后元素的种类、质量不变,根据钾元素的质量为7.80g可得高锰酸钾的质量为7.80g÷![]() =31.6g;
=31.6g;
根据质量守恒定律可得,反应前后物质的总质量不变,生成氧气质量为31.6g﹣30.0g=1.6g;
设生成的锰酸钾的质量为x,二氧化锰的质量为y,分解的高锰酸钾的质量为z
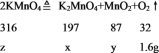
![]()
x=9.85g
y=4.35g
z=15.8g
剩余的高锰酸钾的质量为31.6g﹣15.8g=15.8g。

 三点一测快乐周计划系列答案
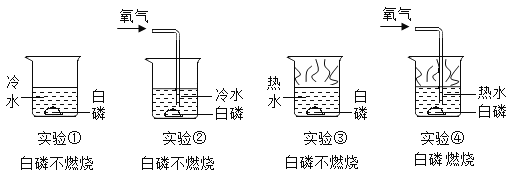
三点一测快乐周计划系列答案【题目】某些铜制品在空气中久置,表面生成绿色的铜锈(又称铜绿)。某化学实验小组设计并进行实验,探究铜锈的组成和铜生锈的条件。
I.探究铜锈的组成
【查阅资料】① 铜锈受热易分解 ② 硫酸铜粉末遇水由白色变为蓝色
【进行实验】 小组同学从铜器上取下适量的干燥铜锈,按图所示装置实验(部分夹持装置已略去)。观察到B中白色粉末变为蓝色,C中澄清石灰水变浑浊。
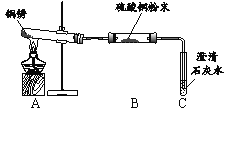
【解释与结论】(1)C中反应的化学方程式是______。
(2)依据以上现象分析,铜锈中一定含有的元素:Cu和______。
II.探究铜生锈的条件
【提出猜想】根据铜锈的组成推测,铜生锈可能与CO2、H2O和O2有关。
【进行实验】实验小组同学取直径、长度均相同的铜丝,并打磨光亮。设计了如下图所示的5个实验并持续观察。
编号 | ① | ② | ③ | ④ | ⑤ |
实验 |
|
|
|
|
|
现象 | 无明显现象 | 无明显现象 | 铜丝表面 有绿色物质 | 无明显现象 | 无明显现象 |
【解释与结论】
(3)实验中使用“经煮沸迅速冷却的蒸馏水”,其目的是______。
(4)得出“铜生锈一定与CO2有关”的结论,依据的两个实验是______(填编号)。
(5)对比实验②和③,得出的结论是______。
(6)为验证猜想,请在图中将实验⑤补充完整。______
(7)由上述实验可推知,铜生锈的条件是______。
【反思与应用】
(8)结合上述实验,你对保存铜制品的建议是______。
【题目】如表是某同学复习整理的部分化学知识,其中完全正确的是
A.化学用语 I2—2个碘原子 He—1个氦气分子 | B.性质用途 石墨能导电,可作电极 稀有气体性质稳定,可制成霓虹灯 |
C.现象描述 磷在空气中燃烧产生大量白雾 硫在空气中燃烧产生淡蓝色火焰 | D.物质分类 焊锡、黄铜、生铁是常见的合金 冰、干冰、双氧水都是氧化物 |
A. A B. B C. C D. D
【题目】蔗糖是生活中常见的一种物质,某兴趣小组对“蔗糖的组成”进行了探究。
(做出猜想)小组同学认为绿色植物通过光合作用将二氧化碳和水转化成葡萄糖和氧气葡萄糖进一步转化为蔗糖,故蔗糖中一定含有碳、氢元素,可能含有氧元素。
(实验验证)
方案一:小明将蔗糖在氧气中燃烧,检验到生成物中有水和二氧化碳,得出结论“蔗糖是由碳、氢、氧三种元素组成的”,小刚认为该方案不合理,只能说明蔗糖中一定含有碳、氢元素,不能确定是否含有氧元素,理由是______。
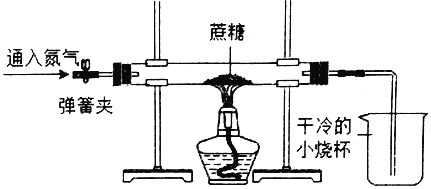
方案二:小刚用如图所示的装置进行实验。实验开始先通入一会儿氮气,然后关闭弹簧夹,点燃酒精灯给蔗糖加强热。
![]() 观察到______,说明蔗糖中含有氢元素和氧元素。
观察到______,说明蔗糖中含有氢元素和氧元素。
![]() 观察到硬质玻璃管中残留有黑色固体,他猜测该黑色固体是单质碳,并继续利用如图所示装置,另选试剂进行了验证单质碳的实验。实验过程和现象如表:
观察到硬质玻璃管中残留有黑色固体,他猜测该黑色固体是单质碳,并继续利用如图所示装置,另选试剂进行了验证单质碳的实验。实验过程和现象如表:
实验操作 | 实验现象 |
往硬质玻璃管中通入 ______ , 并在小烧杯中加入 ______ ,点燃酒精灯 | ①硬质玻璃管中的黑色固体剧烈燃烧,发出白光; ②______ |
![]() 写出上述实验过程中一个反应的化学方程式:______。
写出上述实验过程中一个反应的化学方程式:______。
(实验结论)蔗糖是由碳、氢、氧三种元素组成的。
(拓展交流)方案二中,先通入一会儿氮气的原因是______。