题目内容
 在甲、乙两支完全相同的试管中,装有足量质量相等且同样的稀盐酸,在两只试管上方各罩一个完全相同的气球,两个气球中分别装有质量相同的金属A和B.现同时提起两只气球,使其中的金属迅速与稀盐酸接触反应.实验发现:开始时,甲气球迅速鼓起,而乙气球鼓起较慢;反应结束时,甲气球鼓起比的体积比乙气球的大.根据以上事实,下列推论错误的是:
在甲、乙两支完全相同的试管中,装有足量质量相等且同样的稀盐酸,在两只试管上方各罩一个完全相同的气球,两个气球中分别装有质量相同的金属A和B.现同时提起两只气球,使其中的金属迅速与稀盐酸接触反应.实验发现:开始时,甲气球迅速鼓起,而乙气球鼓起较慢;反应结束时,甲气球鼓起比的体积比乙气球的大.根据以上事实,下列推论错误的是:
- A.金属A比金属,B活泼
- B.A可能是锌,B可能是铁
- C.A可能是Mg,B可能是铝
- D.A可能是Mg,B可能是铁
BC
分析:根据气球鼓起的快慢可判断出氢气产生的快慢,进一步可以得出金属活动性的强弱,根据气球体积的大小可以判断出生成氢气的多少,据此对选项进行分析即可.
解答:根据开始时,甲气球迅速鼓起,而乙气球鼓起较慢.可知A比B产生的氢气快,从而可得在金属活动性顺序中A排在B的前面,即A比B活泼.
根据反应结束时,甲气球鼓起的体积比乙气球大.说明A产生的氢气比B多.根据金属与酸的反应时生成的氢气量=金属的质量×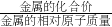 可知相同质量的镁、锌、铝、铁与足量的酸反应时生成的氢气大小关系是:铝>镁>铁>锌,所以BC错误,D正确.
可知相同质量的镁、锌、铝、铁与足量的酸反应时生成的氢气大小关系是:铝>镁>铁>锌,所以BC错误,D正确.
故选BC
点评:本题目既考查了金属活动性顺序也考查了根据化学方程式的计算.体现出了化学中“根据现象,找出原因,判断本质”这一化学理念.
分析:根据气球鼓起的快慢可判断出氢气产生的快慢,进一步可以得出金属活动性的强弱,根据气球体积的大小可以判断出生成氢气的多少,据此对选项进行分析即可.
解答:根据开始时,甲气球迅速鼓起,而乙气球鼓起较慢.可知A比B产生的氢气快,从而可得在金属活动性顺序中A排在B的前面,即A比B活泼.
根据反应结束时,甲气球鼓起的体积比乙气球大.说明A产生的氢气比B多.根据金属与酸的反应时生成的氢气量=金属的质量×
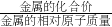 可知相同质量的镁、锌、铝、铁与足量的酸反应时生成的氢气大小关系是:铝>镁>铁>锌,所以BC错误,D正确.
可知相同质量的镁、锌、铝、铁与足量的酸反应时生成的氢气大小关系是:铝>镁>铁>锌,所以BC错误,D正确.故选BC
点评:本题目既考查了金属活动性顺序也考查了根据化学方程式的计算.体现出了化学中“根据现象,找出原因,判断本质”这一化学理念.

练习册系列答案
 一线名师提优试卷系列答案
一线名师提优试卷系列答案
相关题目
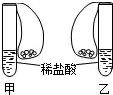 (2004?重庆)如图所示,在甲、乙两支完全相同的试管中,装有足量的质量和溶质质量分数均相同的稀盐酸,在两只试管上方各罩一个完全相同的气球,两个气球中分别装有相同质量的金属A与B,现同时提起两只气球,使其中的金属迅速与稀盐酸接触反应.实验发现:开始时,甲气球迅速鼓起,而乙气球鼓起较慢.反应结束时,甲气球鼓起的体积比乙气球大.根据以上事实,可得出以下结论:
(2004?重庆)如图所示,在甲、乙两支完全相同的试管中,装有足量的质量和溶质质量分数均相同的稀盐酸,在两只试管上方各罩一个完全相同的气球,两个气球中分别装有相同质量的金属A与B,现同时提起两只气球,使其中的金属迅速与稀盐酸接触反应.实验发现:开始时,甲气球迅速鼓起,而乙气球鼓起较慢.反应结束时,甲气球鼓起的体积比乙气球大.根据以上事实,可得出以下结论: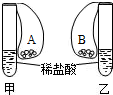 (2012?枣庄二模)在甲、乙两支完全相同的试管中,装有足量质量相等且同样的稀盐酸,在两只试管上方各罩一个完全相同的气球,两个气球中分别装有质量相同的金属A和B.现同时提起两只气球,使其中的金属迅速与稀盐酸接触反应.实验发现:开始时,甲气球迅速鼓起,而乙气球鼓起较慢;反应结束时,甲气球鼓起比的体积比乙气球的大.根据以上事实,下列推论错误的是:( )
(2012?枣庄二模)在甲、乙两支完全相同的试管中,装有足量质量相等且同样的稀盐酸,在两只试管上方各罩一个完全相同的气球,两个气球中分别装有质量相同的金属A和B.现同时提起两只气球,使其中的金属迅速与稀盐酸接触反应.实验发现:开始时,甲气球迅速鼓起,而乙气球鼓起较慢;反应结束时,甲气球鼓起比的体积比乙气球的大.根据以上事实,下列推论错误的是:( )

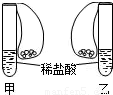 如图所示,在甲、乙两支完全相同的试管中,装有足量的质量和溶质质量分数均相同的稀盐酸,在两只试管上方各罩一个完全相同的气球,两个气球中分别装有相同质量的金属A与B,现同时提起两只气球,使其中的金属迅速与稀盐酸接触反应.实验发现:开始时,甲气球迅速鼓起,而乙气球鼓起较慢.反应结束时,甲气球鼓起的体积比乙气球大.根据以上事实,可得出以下结论:
如图所示,在甲、乙两支完全相同的试管中,装有足量的质量和溶质质量分数均相同的稀盐酸,在两只试管上方各罩一个完全相同的气球,两个气球中分别装有相同质量的金属A与B,现同时提起两只气球,使其中的金属迅速与稀盐酸接触反应.实验发现:开始时,甲气球迅速鼓起,而乙气球鼓起较慢.反应结束时,甲气球鼓起的体积比乙气球大.根据以上事实,可得出以下结论: