题目内容
【题目】有等质量的镁和铁,前者放入质量分数为10%的稀硫酸中,后者放入质量分数为10%的稀盐酸中,产生氢气的质量随时间变化曲线如图所示.下列说法错误的是( )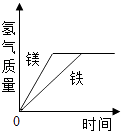
A.镁和铁中至少有一种剩余
B.消耗的稀硫酸和稀盐酸质量相等
C.消耗铁的质量一定大于消耗镁的质量
D.产生氢气的质量相等
【答案】B
【解析】设制取2g氢气需要镁的质量为x,设制取2g氢气需要铁的质量为x,
需稀硫酸的质量为z; 需稀盐酸的质量为m
Mg+ | H2SO4═MgSO4+ | H2↑; | Fe+ | 2HCl═FeCl2+ | H2↑ |
24 | 98 | 2 | 56 | 73 | 2 |
x | z×10% | 2g | y | m×10% | 2g |
![]() =
= ![]() ;
; ![]() =
= ![]() =
= ![]() ;
; ![]() =
= ![]()
解之得:x=24g; z=980g y=56g; m=730g
由上面的计算可知:要想制取相同质量的氢气(2g),需要镁的质量是24g,而需要铁的质量为56g.而题目中指出是相同质量的金属,假设制取2g氢气,需56g铁,因此镁的质量也是56g故镁有剩余:56g﹣24g=32g故A、C的说法是正确的,需要稀硫酸和稀盐酸的质量不相等,故B的说法是错误的.
D、由题目图中可以看出当镁和铁完全反应时,对应纵座标所指相同,故二者生成氢气的质量相等,故D的说法是正确的.
故答案为:B.
题目中没有给出具体的数据,这类题目可以给出一个方便计算的特殊数值,例如物质的相对分子质量等,可设制取2g氢气,然后分别计算所需镁、铁、稀硫酸、稀盐酸的质量.

练习册系列答案
相关题目