题目内容
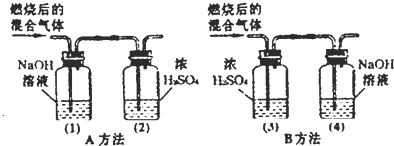 某有机物在氧气中充分燃烧后,产物只有二氧化碳和水.甲、乙两组同学分别用A、两种方法(为如图所示)测定它的组成,得到两组数据(见下表).请你分析:浓H2SO4具有______性.通过测定产物中水的质量,可测定该有机物中______元素的含量.测定该有机物的组成选用正确的方法是______(填A或B).推测该有机物是由______元素组成.
某有机物在氧气中充分燃烧后,产物只有二氧化碳和水.甲、乙两组同学分别用A、两种方法(为如图所示)测定它的组成,得到两组数据(见下表).请你分析:浓H2SO4具有______性.通过测定产物中水的质量,可测定该有机物中______元素的含量.测定该有机物的组成选用正确的方法是______(填A或B).推测该有机物是由______元素组成.
| 燃烧有机物的质量 | 实验方法 | 实验前后(1) | (4)装置的质量 | ||
| 实验前 | 实验后 | ||||
| 甲组 | 3.2g | A | (1)150g | (1)154.6g | |
| (2)150ge | (2)153.4g | ||||
| 乙组 | 3.2g | B | (3)150g | (3)153.6g | |
| (4)150g | (4)154.4g | ||||
解:根据质量守恒定律可知反应前后元素种类不变,有机物燃烧生成二氧化碳和水,可知有机物中含有碳元素和氢元素,也就是说生成的水中的氢元素就是有机物中的氢元素,生成的二氧化碳中碳元素的质量就是有机物中碳元素的质量,浓硫酸质量的增加量是生成水的质量,氢氧化钠的质量的增加量就是生成二氧化碳的质量,在检验二氧化碳质量和水的质量时,要先检验水,再检验二氧化碳,因为通过氢氧化钠溶液时会带上水,所以要根据B方法计算:浓硫酸质量增加了3.6g,所以生成水是3.6g,所以氢元素质量:3.6g×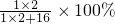 =0.4g,氢氧化钠质量增加了4.4g,所以生成二氧化碳质量为4.4g,所以碳元素质量为:4.4g×
=0.4g,氢氧化钠质量增加了4.4g,所以生成二氧化碳质量为4.4g,所以碳元素质量为:4.4g×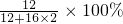 =1.2g,又因为碳元素和氢元素质量和为:0.4g+1.2g=1.6g,因为有机物质量为3.2g,所以有机物中还含有氧元素.
=1.2g,又因为碳元素和氢元素质量和为:0.4g+1.2g=1.6g,因为有机物质量为3.2g,所以有机物中还含有氧元素.
故答案为:吸水性;氢;B;C、H、O.
分析:根据浓硫酸质量的增加量是生成水的质量,再计算出水中氢元素的质量,根据氢氧化钠的质量的增加量就是生成二氧化碳的质量,再计算出碳元素的质量,把碳元素的质量加上氢元素的质量,再与有机物质量比较,看是否含有氧元素.
点评:解答本题的关键是浓硫酸质量的增加量就是生成水的质量,氢氧化钠溶液质量的增加量就是生成的二氧化碳的质量.
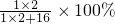 =0.4g,氢氧化钠质量增加了4.4g,所以生成二氧化碳质量为4.4g,所以碳元素质量为:4.4g×
=0.4g,氢氧化钠质量增加了4.4g,所以生成二氧化碳质量为4.4g,所以碳元素质量为:4.4g×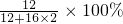 =1.2g,又因为碳元素和氢元素质量和为:0.4g+1.2g=1.6g,因为有机物质量为3.2g,所以有机物中还含有氧元素.
=1.2g,又因为碳元素和氢元素质量和为:0.4g+1.2g=1.6g,因为有机物质量为3.2g,所以有机物中还含有氧元素.故答案为:吸水性;氢;B;C、H、O.
分析:根据浓硫酸质量的增加量是生成水的质量,再计算出水中氢元素的质量,根据氢氧化钠的质量的增加量就是生成二氧化碳的质量,再计算出碳元素的质量,把碳元素的质量加上氢元素的质量,再与有机物质量比较,看是否含有氧元素.
点评:解答本题的关键是浓硫酸质量的增加量就是生成水的质量,氢氧化钠溶液质量的增加量就是生成的二氧化碳的质量.

练习册系列答案
相关题目
某有机物在氧气中充分燃烧后,产生只有二氧化碳和水,甲、乙两组同学分别用下图两种方法测定它的组成.请你分析,并参与测定工作;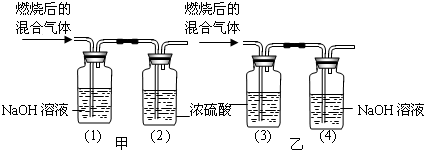
(1)你选用的实验装置是 (“甲”或“乙”),你不选另一个装置的原因是 .
(2)根据表中数据,推测出该有机物是由 元素组成的,各元素的质量比为 (假设实验过程中气体均全部被吸收).
提示:浓硫酸可以吸收水蒸气,氢氧化钠可以吸收二氧化碳.

| 燃烧有机物的质量 | 实验装置 | 实验(1)~(4)装置质量 | ||
| 实验前 | 实验后 | |||
| 甲组 | 1.6g | 甲 | (1)150g | (1)154.6g |
| (2)150g | (1)153.4g | |||
| 乙组 | 1.6g | 乙 | (3)150g | (1)153.6g |
| (4)150g | (1)154.4g | |||
(2)根据表中数据,推测出该有机物是由
提示:浓硫酸可以吸收水蒸气,氢氧化钠可以吸收二氧化碳.
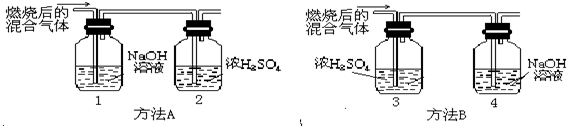
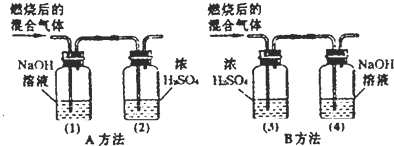 (2005?青浦区)某有机物在氧气中充分燃烧后,产物只有二氧化碳和水.甲、乙两组同学分别用A、两种方法(为如图所示)测定它的组成,得到两组数据(见下表).请你分析:浓H2SO4具有
(2005?青浦区)某有机物在氧气中充分燃烧后,产物只有二氧化碳和水.甲、乙两组同学分别用A、两种方法(为如图所示)测定它的组成,得到两组数据(见下表).请你分析:浓H2SO4具有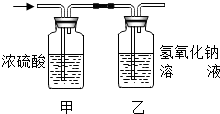 (2012?牡丹江)某有机物在氧气中充分燃烧,将生成的水蒸气、二氧化碳气体依次通过装置甲和乙 (假设每步吸收完全),称量通入气体前后装置的质量,数据如下:
(2012?牡丹江)某有机物在氧气中充分燃烧,将生成的水蒸气、二氧化碳气体依次通过装置甲和乙 (假设每步吸收完全),称量通入气体前后装置的质量,数据如下: