题目内容
【题目】实验室以MnO2为原料制备少量高纯MnCO3的流程如下: 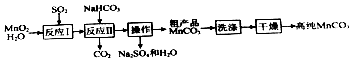
已知:①反应Ⅰ的化学方程式:MnO2+SO2═MnSO4;
②MnCO3、Mn(OH)2均难溶于水,MnCO3在100℃时开始分解.
(1)反应Ⅰ属于基本反应类型中的反应.
(2)流程中“操作”的名称为 , 所需要的主要玻璃仪器有 .
(3)反应Ⅱ的化学方程式为 . 反应Ⅱ需控制溶液的酸碱性,若碱性过强,MnCO3粗产品中将混有(填化学式).
(4)验证MnCO3粗产品表面附着有Na2SO4杂质:取样品少许,向其中加入水,搅拌、过滤,向滤液中加入适量的(填化学式)溶液,有白色沉淀产生.
(5)为获得高纯MnCO3 , 需选择“低温”干燥的原因是 .
【答案】
(1)化合
(2)过滤;漏斗、玻璃棒、烧杯
(3)MnSO4+2NaHCO3=Na2SO4+MnCO3↓+CO2↑+H2O;Mn(OH)2
(4)BaCl2
(5)MnCO3的分解温度为100℃,为防止MnCO3高温分解,影响高纯MnCO3的纯度
【解析】解:(1)反应Ⅰ的化学方程式:MnO2+SO2═MnSO4,为两种物质变成一种,多变一,为化合反应,所以反应Ⅰ属于基本反应类型中的化合反应.(2)流程中“操作”过后,难溶性物质碳酸锰和硫酸钠溶液得到分离,该步骤为过滤,所需要的主要玻璃仪器有漏斗、玻璃棒、烧杯.(3)反应Ⅱ中加入的是反应I的生成物硫酸锰和新加入的碳酸氢钠,生成物为过滤得到的碳酸锰和溶液中的硫酸钠以及生成的气体二氧化碳.对应的化学方程式为MnSO4+2NaHCO3=Na2SO4+MnCO3↓+CO2↑+H2O.反应Ⅱ需控制溶液的酸碱性,若碱性过强,则硫酸锰和碱反应生成难溶性氢氧化锰沉淀(4)验证MnCO3粗产品表面附着有Na2SO4杂质,也就是检验硫酸根的存在,通常用含钡离子的可溶物进行检验:取样品少许,向其中加入水,搅拌、过滤,向滤液中加入适量的 BaCl2溶液,有白色沉淀产生.(5)为获得高纯MnCO3,需选择“低温”干燥的原因是 MnCO3的分解温度为100℃,低温可以防止MnCO3高温分解,保证高纯MnCO3的纯度
所以答案是:(1)化合.(2)过滤;漏斗、玻璃棒、烧杯.(3)MnSO4+2NaHCO3=Na2SO4+MnCO3↓+CO2↑+H2O. Mn(OH)2.(4)BaCl2.(5)MnCO3的分解温度为100℃,为防止MnCO3高温分解,影响高纯MnCO3的纯度
【考点精析】根据题目的已知条件,利用过滤操作的注意事项的相关知识可以得到问题的答案,需要掌握过滤操作注意事项:“一贴”“二低”“三靠;过滤后,滤液仍然浑浊的可能原因有:①承接滤液的烧杯不干净②倾倒液体时液面高于滤纸边缘③滤纸破损.

 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案