题目内容
抗战时期,我国军民用硝酸钾、硫和木炭混合制造了大量土地雷,运用地雷战等游击战术给日本侵略者以沉重的打击.
(1)硝酸钾可用硝土与草木灰加水混合制得.硝土的主要成分之一是Ca(NO3)2,草木灰的主要成分是______.将硝土溶于水除去不溶物,加入适量的草木灰可以得到硝酸钾溶液,同时生成碳酸钙,该反应的化学方程式是______,该反应的基本类型是______.
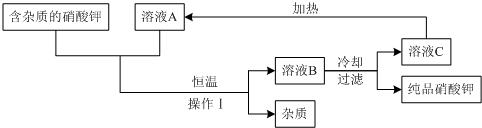
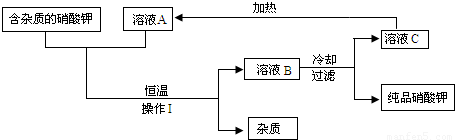
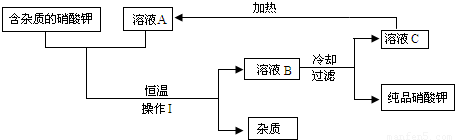
(2)含有不溶于水的固体杂质的硝酸钾,可用如下图的循环流程进行提纯,得到纯度较高的硝酸钾固体,其中溶液A、B、C均是化合物X的水溶液.
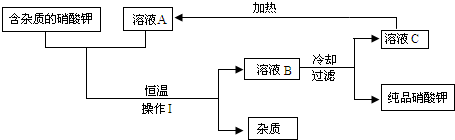
请根据以上流程回答下列问题:
①操作Ⅰ的名称是______.
②化合物X为______.
③若溶液A、B、C中溶质X的质量分数分别表示为a%、b%、c%,则a、b、c的大小关系是______;溶液A、B、C中一定是饱和溶液的是______.
解:(1)草木灰是我们熟悉的物质,是常见的盐,其主要成分是碳酸钾;Ca(NO3)2与其发生复分解反应生成了白色沉淀碳酸钙和常见的复合肥硝酸钾
(2)将“不溶于水的固体杂质的硝酸钾”转变成“纯度较高的硝酸钾固体”,利用了硝酸钾的性质,分别利用过滤法、冷却热饱和法、重结晶法.
故答案:(1)K2CO3或碳酸钾;Ca(NO3)2+K2CO3→CaCO3↓+2KNO3;复分解反应
(2)①过滤 ②KNO3或硝酸钾 ③b>c=a C
分析:草木灰是农村最常见的,它的主要成分是碳酸钾;由题中信息可知,Ca(NO3)2与K2CO3反应生成了硝酸钾溶液和碳酸钙,是两种盐的反应,属于复分解反应.(2)图示的除去硝酸钾中的杂质,要想将含杂质(不溶于水)的硝酸钾中的杂质进行分离,需操作Ⅰ的过滤(固液互不溶分离),题目中“A、B、C均是化合物X的水溶液”那么化合物X一定是硝酸钾,其中在恒温下B溶液中X的质量分数最大,A与C的质量分数相同;由于硝酸钾的溶解度随温度的升高逐渐增大,溶液B到C,经过冷却热饱和法,它的溶解度降低,有晶体析出是饱和溶液.
点评:本题是一道综合性很强的实验探究题,考查了生活生产中常用的盐硝酸钾的性质、用途、制取等;其中这里涉及到一种得到较高纯度的方法--重结晶.晶体溶于溶剂或熔融以后,又重新从溶液或熔体中结晶的过程.又称再结晶.重结晶可以使不纯净的物质获得纯化,或使混合在一起的盐类彼此分离.重结晶的效果与溶剂选择大有关系,最好选择对主要化合物是可溶性的,对杂质是微溶或不溶的溶剂,滤去杂质后,将溶液浓缩、冷却,即得纯制的物质.
(2)将“不溶于水的固体杂质的硝酸钾”转变成“纯度较高的硝酸钾固体”,利用了硝酸钾的性质,分别利用过滤法、冷却热饱和法、重结晶法.
故答案:(1)K2CO3或碳酸钾;Ca(NO3)2+K2CO3→CaCO3↓+2KNO3;复分解反应
(2)①过滤 ②KNO3或硝酸钾 ③b>c=a C
分析:草木灰是农村最常见的,它的主要成分是碳酸钾;由题中信息可知,Ca(NO3)2与K2CO3反应生成了硝酸钾溶液和碳酸钙,是两种盐的反应,属于复分解反应.(2)图示的除去硝酸钾中的杂质,要想将含杂质(不溶于水)的硝酸钾中的杂质进行分离,需操作Ⅰ的过滤(固液互不溶分离),题目中“A、B、C均是化合物X的水溶液”那么化合物X一定是硝酸钾,其中在恒温下B溶液中X的质量分数最大,A与C的质量分数相同;由于硝酸钾的溶解度随温度的升高逐渐增大,溶液B到C,经过冷却热饱和法,它的溶解度降低,有晶体析出是饱和溶液.
点评:本题是一道综合性很强的实验探究题,考查了生活生产中常用的盐硝酸钾的性质、用途、制取等;其中这里涉及到一种得到较高纯度的方法--重结晶.晶体溶于溶剂或熔融以后,又重新从溶液或熔体中结晶的过程.又称再结晶.重结晶可以使不纯净的物质获得纯化,或使混合在一起的盐类彼此分离.重结晶的效果与溶剂选择大有关系,最好选择对主要化合物是可溶性的,对杂质是微溶或不溶的溶剂,滤去杂质后,将溶液浓缩、冷却,即得纯制的物质.

练习册系列答案
相关题目