题目内容
【题目】某化学兴趣小组通过实验探究分解氯酸钾制氧气的反应中二氧化锰的作用,
(1)该反应的化学方程式为。
(2)【设计实验】用图1所示装置进行实验, 步骤如下: 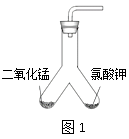
步骤Ⅰ:;
步骤Ⅱ:装入药品;
步骤Ⅲ:加热右侧支管,用带火星的木条在导管口检验生成的气体;
步骤Ⅳ:冷却后,将装置倾斜,使左侧支管中的药品进入右侧支管,再加热右侧支管,用带火星的木条在导管口检验生成的气体。
(3)【实验现象】步骤Ⅲ和步骤Ⅳ中,一段时间后都能观察到带火星的木条复燃,但不同的是。
(4)【交流反思】要想确认分解氯酸钾制氧气的反应中二氧化锰是催化剂,还需通过实验证明二氧化锰的和在反应前后都没有发生变化。
(5)【拓展探究】在老师的指导下,该小组同学利用图2所示装置继续进行深入探究。以氧气的体积分数为纵坐标,温度为横坐标,得到图3 所示曲线(图中的“1︰2”、“1︰1”、“2︰1”、“3︰1”、“4︰1”、“5︰1”指氯酸钾和二氧化锰的质量比)。 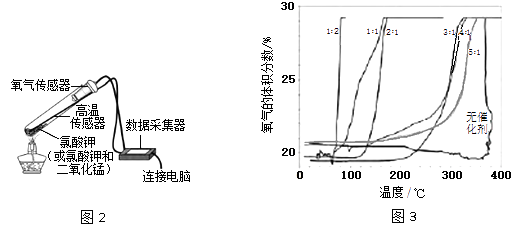
【实验分析】根据图3,氯酸钾的分解温度随氯酸钾和二氧化锰的质量比变化的大致规律是;分解氯酸钾制氧气的反应中二氧化锰起催化作用,可能是因为二氧化锰能。
(6)【交流应用】将29.4g氯酸钾和二氧化锰的混合物(氯酸钾和二氧化锰的质量比为5︰1)加热至完全反应,剩余固体的质量为。
【答案】
(1)2KClO3 ![]() 2KCl+3O2↑
2KCl+3O2↑
(2)检查装置的气密性
(3)步骤IV中带火星的木条复燃较快
(4)质量,化学性质
(5)氯酸钾和二氧化锰的质量比越小,氯酸钾的分解温度越低,降低氯酸钾的分解温度
(6)19.8g
【解析】通过分解氯酸钾制取氧气,该反应的化学方程式为∶2KClO3 ![]() 2KCl+3O2↑。
2KCl+3O2↑。
步骤Ⅰ:检查装置的气密性;步骤Ⅱ:装入药品;
步骤Ⅲ:加热右侧支管,用带火星的木条在导管口检验生成的气体;
步骤Ⅳ:冷却后,将装置倾斜,使左侧支管中的药品进入右侧支管,再加热右侧支管,用带火星的木条在导管口检验生成的气体。
【实验现象】步骤Ⅲ和步骤Ⅳ中,一段时间后都能观察到带火星的木条复燃,但不同的是步骤IV中带火星的木条复燃较快。
【交流反思】要想确认分解氯酸钾制氧气的反应中二氧化锰是催化剂,还需通过实验证明二氧化锰的质量和化学性质在反应前后都没有发生变化。
【拓展探究】继续进行深入探究,氯酸钾和二氧化锰的质量比。
【实验分析】根据图3,氯酸钾的分解温度随氯酸钾和二氧化锰的质量比变化的大致规律是氯酸钾和二氧化锰的质量比越小,氯酸钾的分解温度越低;分解氯酸钾制氧气的反应中二氧化锰起催化作用,可能是因为二氧化锰能降低氯酸钾的分解温度。
【交流应用】将29.4g氯酸钾和二氧化锰的混合物(氯酸钾和二氧化锰的质量比为5︰1)加热至完全反应,剩余固体的质量为∶
混合物中氯酸钾质量为∶29.4g× ![]() =24.5g.
=24.5g.
解∶设加热完全分解19.6g氯酸钾,生成氧气为x
2KClO3 | 3O2↑ |
2×122.5 | 96 |
24.5g | x |
![]() =
= ![]() ,x=9.6g
,x=9.6g
剩余固体的质量为∶29.4g-9.6g=19.8g.。
【考点精析】本题主要考查了催化剂的特点与催化作用和根据化学反应方程式的计算的相关知识点,需要掌握催化剂(触媒):在化学反应中能改变其他物质的化学反应速率,而本身的质量和化学性质在反应前后都没有发生变化的物质.(一变两不变)催化剂在化学反应中所起的作用叫催化作用;各物质间质量比=系数×相对分子质量之比才能正确解答此题.

【题目】石灰石进行煅烧实验,过程如下(假设杂质不发生变化)。

① 煅烧石灰石的化学方程式为____________________;
② 利用滤液A或滤渣B设计方案证明石灰石分解情况。
实验操作 | 判断依据 | 结论 |
_________ | __________ | 石灰石已分解 |
________ | ___________ | 石灰石完全分解 |
【题目】现有a、b、c三种金属,a、b分别与稀硫酸、c的硝酸盐溶液作用的现象如下表所示:
a | b | |
与稀硫酸作用 | 无反应 | 溶解并放出气体 |
与c的硝酸盐 | 表面上析出c | 表面上析出c |
根据表中所给的实验结果,判断这三种金属活动性由强到弱的顺序正确的是()
A.c、b、aB.a、b、cC.b、a、cD.a、c 、b