题目内容
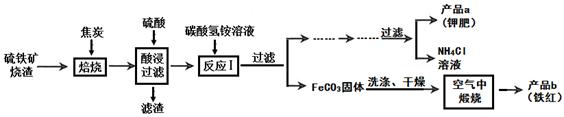
某化工厂为了综合利用生产过程中的副产品CaSO4 ,与相邻的化肥厂联合设计了以下制备(NH4)2SO4的工艺流程。在下图流程中,沉淀池里物质发生的主要化学反应为:
CO2+2NH3+CaSO4+H2O = CaCO3↓+(NH4)2SO4 。
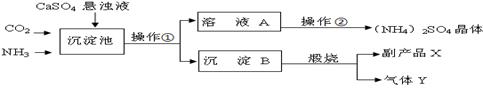
(1)沉淀B高温煅烧反应的化学方程式 ,反应的基本类型属于 ,该工艺中可循环使用的物质为 (填化学式)。
(2)实验室里操作①称为 ,实验室进行此操作时,用到玻璃棒,其作用是 。操作②的过程是加热浓缩、 、结晶,获得(NH4)2SO4晶体。
(3)从绿色化学和资源综合利用的角度说明上述流程的主要优点是
。
CO2+2NH3+CaSO4+H2O = CaCO3↓+(NH4)2SO4 。

(1)沉淀B高温煅烧反应的化学方程式 ,反应的基本类型属于 ,该工艺中可循环使用的物质为 (填化学式)。
(2)实验室里操作①称为 ,实验室进行此操作时,用到玻璃棒,其作用是 。操作②的过程是加热浓缩、 、结晶,获得(NH4)2SO4晶体。
(3)从绿色化学和资源综合利用的角度说明上述流程的主要优点是
。
(1)CaCO3高温CaO+CO2↑ (2分) 分解反应(1分) CO2(1分)
(2)过滤(1分) 引流(1分) 冷却或降温(1分)
(3)产生的CO2循环使用,得到的产品和副产品都是有用的物质,无废物产生(2分)
(2)过滤(1分) 引流(1分) 冷却或降温(1分)
(3)产生的CO2循环使用,得到的产品和副产品都是有用的物质,无废物产生(2分)
试题分析:(1)根据题意可知,沉淀B为碳酸钙,碳酸钙在高温煅烧时,生成氧化钙和二氧化碳,故反应的化学方程式为CaCO3高温CaO+CO2↑;由于该反应的反应物是一种物质,生成了两种其他物质,故属于分解反应;由流程图可知,CO2是该工艺中可循环使用的物质。
(2)根据题意,将不溶于水的沉淀碳酸钙与溶液分离,其操作的方法应是过滤,过滤中用到的玻璃棒的作用是引流;操作②中,要使硫酸铵从其溶液中结晶析出,方法是先加热制成饱和溶液,再降温冷却,结晶析出。
(3)根据图示可知,这一实验的主要优点是产生的CO2可循环使用,故不污染环境而且有些原料可循环使用。
点评:理解和熟记物质的相互转化和制备方法,以及与之相关的知识,是解答本题的关键,此外还要注意利用题目所给的信息,结合所学知识进行解答。

练习册系列答案
 经典密卷系列答案
经典密卷系列答案 金牌课堂练系列答案
金牌课堂练系列答案 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案
相关题目