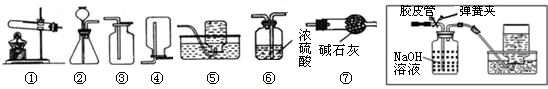
题目内容
以下是我们熟悉的实验室制取气体的发生装置、收集装置.请根据装置图1回答下列问题:
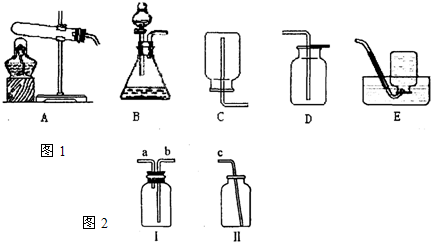
(1)实验室制取二氧化碳应选用的装置为
(2)写出用上述装置A制取氧气的化学反应方程式:
(3)常温下NO是一种无色、难溶于水的气体,密度比空气略大,在空气中与氧气迅速反应生成红棕色的NO2气体.请你利用图2仪器I、Ⅱ,设计收集一瓶较纯净的NO的操作方法:

(1)实验室制取二氧化碳应选用的装置为
BD
BD
(填装置的编号),写出该反应的化学方程式:CaCO3+2HCl═CaCl2+CO2↑+H2O
CaCO3+2HCl═CaCl2+CO2↑+H2O
.(2)写出用上述装置A制取氧气的化学反应方程式:
2KClO3
2KCl+3O2↑
| ||
| △ |
2KClO3
2KCl+3O2↑
.若选择装置B制取氧气,如果锥形瓶内反应太剧烈,可减慢反应最方便的方法是
| ||
| △ |
减慢分液漏斗中液体滴加的速度
减慢分液漏斗中液体滴加的速度
.(3)常温下NO是一种无色、难溶于水的气体,密度比空气略大,在空气中与氧气迅速反应生成红棕色的NO2气体.请你利用图2仪器I、Ⅱ,设计收集一瓶较纯净的NO的操作方法:
在瓶Ⅰ中装满水,用胶管将b、c连接起来,利用排水法将NO收集在瓶Ⅰ中
在瓶Ⅰ中装满水,用胶管将b、c连接起来,利用排水法将NO收集在瓶Ⅰ中
.分析:(1)根据实验室用大理石和稀盐酸反应制取二氧化碳的原理、药品状态、反应条件、二氧化碳的溶解性和密度回答;
(2)该装置适合固固加热型制取氧气,注意试管口是否有棉花,选择合适的方法;减慢反应的可以通过控制液体的流速来进行;
(3)根据一氧化氮的密度和溶解性回答.
(2)该装置适合固固加热型制取氧气,注意试管口是否有棉花,选择合适的方法;减慢反应的可以通过控制液体的流速来进行;
(3)根据一氧化氮的密度和溶解性回答.
解答:解:(1)实验室用大理石和稀盐酸反应制取二氧化碳的原理是碳酸钙与盐酸反应生成氯化钙、水、二氧化碳,方程式为CaCO3+2HCl═CaCl2+CO2↑+H2O;药品为固体大理石和液体稀盐酸,反应条件是常温,发生装置选B;二氧化碳能溶于水,不能用排水法收集,其密度比空气大,用向上排空气法收集,装置为D.
CaCO3+2HCl═CaCl2+CO2↑+H2O
(2)该装置适合制取氧气的方法是加热氯酸钾和二氧化锰的混合物,反应的方程式为:2KClO3
2KCl+3O2↑;
该如果反应器中反应很剧烈,应该采取的安全措施是:通过分液漏斗的活塞减慢液体的滴加速度;
(3)题目已经给出NO的有关信息:难溶于水的气体,密度比空气略大,因此最好使用排水法,所以应该先将I装满水.连接装置时,应该用胶管将b与c相连组成收集装置,收集时,应先在Ⅰ中装满水.
故答案为:(1)BD CaCO3+2HCl═CaCl2+CO2↑+H2O;(2)2KClO3
2KCl+3O2↑;减慢分液漏斗中液体滴加的速度;
(3)在瓶Ⅰ中装满水,用胶管将b、c连接起来,利用排水法将NO收集在瓶Ⅰ中.
CaCO3+2HCl═CaCl2+CO2↑+H2O
(2)该装置适合制取氧气的方法是加热氯酸钾和二氧化锰的混合物,反应的方程式为:2KClO3
| ||
| △ |
该如果反应器中反应很剧烈,应该采取的安全措施是:通过分液漏斗的活塞减慢液体的滴加速度;
(3)题目已经给出NO的有关信息:难溶于水的气体,密度比空气略大,因此最好使用排水法,所以应该先将I装满水.连接装置时,应该用胶管将b与c相连组成收集装置,收集时,应先在Ⅰ中装满水.
故答案为:(1)BD CaCO3+2HCl═CaCl2+CO2↑+H2O;(2)2KClO3
| ||
| △ |
(3)在瓶Ⅰ中装满水,用胶管将b、c连接起来,利用排水法将NO收集在瓶Ⅰ中.
点评:本题考查了气体的制取及实验方案的设计,要求学生能在已有的知识基础上学会变通,灵活运用.

练习册系列答案
 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案
相关题目