题目内容
为了比较铝与相同pH的稀盐酸和稀硫酸反应的快慢,某化学兴趣小组做了如下探究实验.
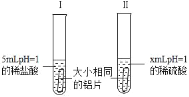
(1)铝与稀硫酸反应的化学方程式为_____.
(2)x=_____,选择此数值的理由_____.实验过程中,可以通过观察_____来比较铝与稀盐酸和稀硫酸反应的剧烈程度.
(3)实验过程中,发现铝与稀盐酸反应更加剧烈,同学们提出了以下猜想:
猜想一:试管Ⅰ中氯离子对反应起了促进作用;
猜想二:试管Ⅱ中硫酸根离子对反应起了阻碍作用;
猜想三:以上两种猜想同时成立.
为了验证上述猜想是否正确,向试管Ⅰ中加入少量_____(填序号),向试管Ⅱ中加入少量_____(填序号),作对比实验.
A 硫酸铜 B 氯化钠 C 硫酸钠 D 浓盐酸
(4)通过(3)中的对比实验,观察到试管Ⅰ中反应快慢无明显变化,试管Ⅱ中反应明显加剧,则_____猜想成立.
练习册系列答案
相关题目




 表示钠原子,
表示钠原子, 表示氯原子,
表示氯原子, 表示氧原子)请回答题:
表示氧原子)请回答题: