题目内容
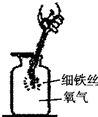
将干燥的氯酸钾与二氧化锰混合固体16g放到大试管中加热,完全反应后,冷却到反应前的温度,称量得剩余固体的质量为11.2g.
(1)根据______定律可得生成氧气的质量为______g,
(2)氯酸钾的质量为______.
(1)根据______定律可得生成氧气的质量为______g,
(2)氯酸钾的质量为______.
(1)根据质量守恒定律,生成氧气的质量=16g-11.2g=4.8g;
(2)设氯酸钾的质量为x,
2KClO3
2KCl+3O2↑
245 96
x 4.8g
∴
=
,
解之得:x=12.25g.
故答案为:(1)质量守恒,4.8;
(2)12.25g.
(2)设氯酸钾的质量为x,
2KClO3
| ||
| △ |
245 96
x 4.8g
∴
| 245 |
| 96 |
| x |
| 4.8g |
解之得:x=12.25g.
故答案为:(1)质量守恒,4.8;
(2)12.25g.

练习册系列答案
 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案
相关题目
(12分)(1)小云从电视新闻中了解到:国家新版《生活饮用水卫生标准》已从今年7月1日起强制实施,其中饮用水消毒剂除了目前采用的液氯以外,补充了——氯胺(NH2Cl)、臭氧(O3)。
①O3中氧元素的化合价是 。
②NH2Cl由 (填数字)种元素组成,其中氮元素与氢元素的质量比是 。
③NH2Cl用消毒时,发生反应NH2Cl+X==NH3+HClO,其中X的化学式是 。
(2)小雨阅读课外资料得知:双氧水分解除了用二氧化锰还可用氧化铜等物质作催化剂,于是他对氧化铜产生了探究兴趣。
【提出问题】氧化铜是否也能作氯酸钾分解的催化剂?它是否比二氧化锰催化效果更好?
【设计实验】小雨以生成等体积的氧气为标准,设计了下列三组实验(其它可能影响实验的因素均忽略)。
| 实验序号 | KClO3质量 | 其他物质质量 | 待测数据 |
| Ⅰ | 1.2g | | |
| Ⅱ | 1.2g | CuO 0.5g | |
| Ⅲ | 1.2g | MnO2 0.5g | |
②若实验Ⅱ比实验Ⅰ的“待测数据”更 (填“大”或“小”),说明氧化铜能加快氯酸钾的分解速率。
③将实验Ⅱ反应后的固体加水溶解、过滤、洗涤、干燥,若称量得到0.5g黑色粉末,再将黑色粉末放入试管中, 。(简述操作和现象)
【预期结论】氧化铜还能作氯酸钾的催化剂。
【评价设计】你认为小雨设计实验Ⅲ和实验Ⅱ对比的目的是 。
(3)小雪用如下图所示装置制取氧气的相关数据如下表。回答有关问题:
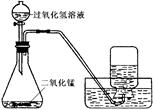
| | 气体发生装置内物质的总质量 |
| 反应前 | 35.6g |
| 反应后 | 34.8g |
②计算参加反应的过氧化氢的质量,写出必要的计算过程。
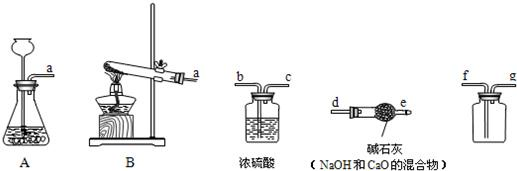

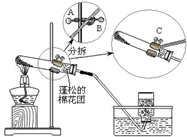 Ⅰ.通过一月的化学学习,你应该知道有多种途径可以制取氧气.如:
Ⅰ.通过一月的化学学习,你应该知道有多种途径可以制取氧气.如: