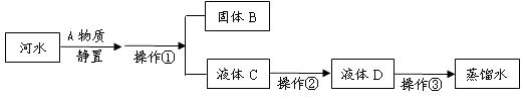
题目内容
【题目】元素周期表是学习和研究化学的重要工具,它的内容十分丰富。下表是依据元素周期表画出的1—18号元素的原子结构示意图。我对它进行研究: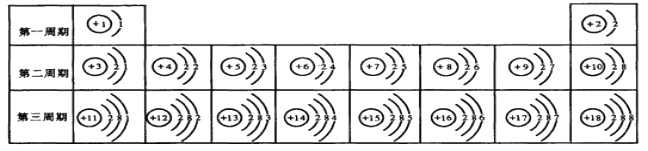
(1)原子序数为17的元素的原子容易(填“得”或“失”)电子;原子序数为13的元素属于元素(填“金属”或“非金属”)。
(2)表中不同种元素最本质的区别是(填番号)
A.质子数不同;
B.中子数不同
C.相对原子质量不同;
D.电子数不同
(3)元素周期表中每一横行叫一周期,每一竖行叫一族。某元素的原子结构示意
图 ![]() ,则该元素应排在第 周期族,它的化学性质和上表的和(填元素名称)的化学性质最相似 ,据你所学的知识推测该元素属于(金属或非金属)元素。
,则该元素应排在第 周期族,它的化学性质和上表的和(填元素名称)的化学性质最相似 ,据你所学的知识推测该元素属于(金属或非金属)元素。
(4)阅读下文,回答问题。
实验证明:在上表同一横行,从左到右,原子失去电子的能力逐渐减弱,得到电子的能力逐渐增强;在同一纵行中,从上到下,原子失去电子的能力逐渐增强,得到电子的能力逐渐减弱。上表中,失去电子能力最强的原子是(填原子符号,下同),得到电子能力最强的原子是.
【答案】
(1)得,金属
(2)A
(3)5,ⅦA,氟元素,氯元素,非金属
(4)Na,F
【解析】(1)非金属元素:最外层电子数≥4,易得电子,原子序数为17的元素的原子最外层电子数为7,故容易得电子;原子序数为13的元素是铝元素,是“金字旁”,属于金属元素;
(2)元素:具有相同质子数(或核电荷数)的一类原子的总称,因此:元素的种类由原子的质子数决定,质子数不同,元素种类不同;故选A;
(3)在元素周期表中:周期数=电子层数,族数=最外层电子数,故则该元素应排在第5周期ⅦA族。元素的化学性质由原子的最外层电子数决定.当两种原子的最外层电子数相同,则这两种元素的化学性质相似.故它的化学性质和上表的氟元素和氯元素的化学性质最相似.根据最外层电子数=7>4,故推测该元素属于非金属元素;
(4)根据同一横行,从左到右,原子失去电子的能力逐渐减弱,得到电子的能力逐渐增强;在同一纵行中,从上到下,原子失去电子的能力逐渐增强,得到电子的能力逐渐减弱。上表中,失去电子能力最强的原子是Na,得到电子能力最强的原子是F.

 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案