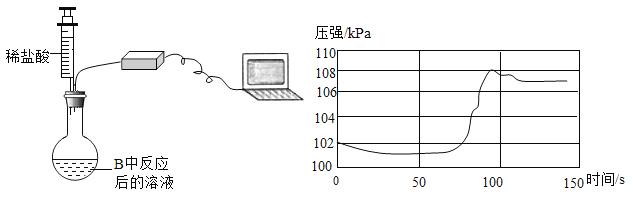
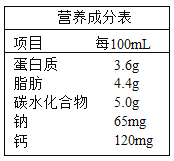
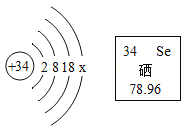
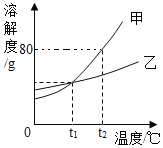
题目内容
【题目】过氧化钙(CaO2)是一种对环境友好的多功能无机化合物,通常有两种制备方法。已知:温度过高过氧化物会分解生成氧化物和氧气。
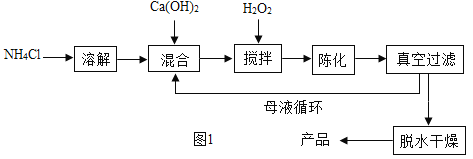
方法 1:由Ca(OH)2为原料最终反应制得,其制备流程如图:
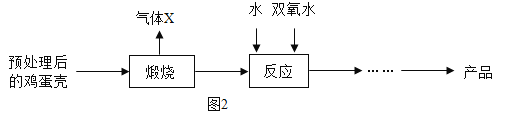
方法 2:由鸡蛋壳(含CaCO3高达 90%)为原料最终反应制得,其制备流程如图:
(1)方法 1 中搅拌的目的是_____。请将搅拌过程中发生反应的化学方程式补充完整![]() _____
_____![]() .制备过程中除水外可循环使用的物质是_____(填化学式)。
.制备过程中除水外可循环使用的物质是_____(填化学式)。
(2)方法 2 中气体 X 是_____,实验室常用_溶液来吸收。煅烧后的反应是化合反应,也能生成CaO28H2O,反应的化学方程式为_____。该反应需控制温度在 0~2℃,可将反应器放置在_,获得的CaO2产品中主要含有的固体杂质是_(填化学式)。
(3)这两种制法均要求在低温下进行(除煅烧外),温度过高会造成氨水挥发外,还能_____。
(4)“绿色化学”一般是指反应物的原子全部转化为期望的最终产物,则上述两种方法中生成CaO28H2O的反应符合“绿色化学”的是________(填“方法 1”或“方法 2”)。
【答案】使反应充分,提高原料利用率 H2O NH4Cl CO2 NaOH或碱液 ![]() 冰水中 Ca(OH)2 使
冰水中 Ca(OH)2 使![]() 分解 方法1
分解 方法1
【解析】
(1)搅拌可以使药品均匀混合,所以方法1中搅拌的目的是:使反应充分,提高原料利用率;依据质量守恒定律可知,化学反应前后原子个数不变,所以需要补充的物质是水,氯化铵既出现在了反应物中,也出现在了生成物中,所以制备过程中除水外可循环使用的物质是:NH4Cl;
(2)鸡蛋壳的主要成分是碳酸钙,碳酸钙在高温的条件下生成氧化钙和二氧化碳,所以X是二氧化碳,在实验室常用氢氧化钠来吸收二氧化碳,氧化钙与水反应生成氢氧化钙,氢氧化钙和双氧水反应生成过氧化钙晶体,化学方程式为:![]() ,冰水混合物的温度是0℃,所以反应需控制温度在0~2℃,可将反应器放置在冰水中,氢氧化钙是反应物,但是在反应过程中不一定会完全反应,所以获得的
,冰水混合物的温度是0℃,所以反应需控制温度在0~2℃,可将反应器放置在冰水中,氢氧化钙是反应物,但是在反应过程中不一定会完全反应,所以获得的![]() 产品中主要含有的固体杂质是
产品中主要含有的固体杂质是![]() ;
;
(3)依据题中的知识可知,温度过高过氧化物会分解生成氧化物和氧气,所以温度过高会造成氨水挥发外,还能使![]() 分解;
分解;
(4)“绿色化学”一般是指反应物的原子全部转化为期望的最终产物,方法1中副产物氯化铵可以循环利用,方法2中有副产物二氧化碳,所以上述两种方法中生成![]() 的反应符合“绿色化学”的是:方法1。
的反应符合“绿色化学”的是:方法1。

 阅读快车系列答案
阅读快车系列答案【题目】在密闭容器内加入氧气、二氧化碳、水蒸气和一种未知物质 W,在一定条件下充分反应,测得反应前后各物质的质量如下表所示。下列说法中正确的是
物质 | 氧气 | 二氧化碳 | 水蒸气 | W |
反应前质量/g | 50 | 1 | 1 | 23 |
反应后质量/g | 2 | 45 | 28 | x |
A.x的值应为2
B.该反应可能是分解反应
C.反应中的氧气和二氧化碳的质量比为25:22
D.w物质中碳元素的质量等于二氧化碳中碳元素的质量