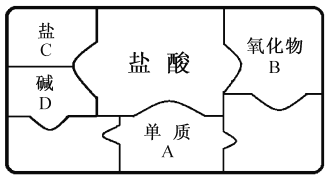
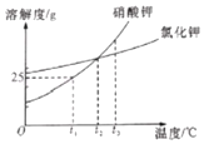
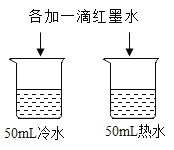
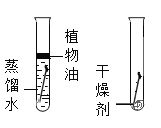
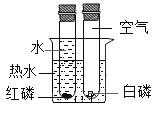
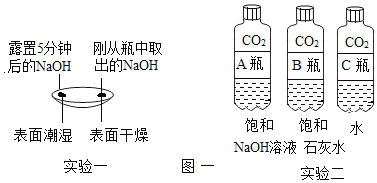
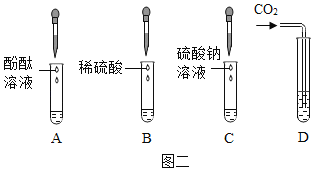
题目内容
【题目】某溶液中可能含有碳酸钠、硫酸钠、氯化钠、硝酸钠中的一种成几种,为测定其成分,进行如下实验。取样,先后逐滴加入氯化钡溶液、稀硝酸,产生沉淀的质量与时间的关系如图所示。
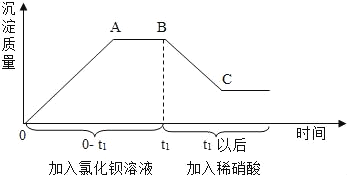
(1)由上述实验可知,原溶液中一定含有_____。
(2)实验中,AB之间图象所对应的溶液中的溶质定有_____ (填化学式,下同)。BC段减少的沉淀是_____。
【答案】碳酸钠、硫酸钠 BaCl2、NaCl BaCO3。
【解析】
(1)碳酸钠与氯化钡反应生碳酸钡和氯化钠,硫酸钠与氯化钡反应生硫酸钡和氯化钠;碳酸钡与稀硝酸反应生成硝酸钡、水和二氧化碳,碳酸钡能溶于稀硝酸;硫酸钡与稀硝酸不能反应,硫酸钡不溶于稀硝酸。由图像情况可以看出加入氯化钡生成沉淀,加入稀硝酸后沉淀溶解了一部分,但沉淀还有一部分没有溶解,不溶解的沉淀是硫酸钡,溶解的沉淀则是碳酸钡,该溶液中的物质一定会有碳酸钠和硫酸钠;
(2)AB之间图像说明是氯化钡和碳酸钠、硫酸钠反应后过量的情况,因此所对应的溶液中的溶质一定有过量的氯化钡、反应生成的氯化钠,化学式分别为:BaCl2、NaCl; BC段减少的沉淀是能够溶于稀硝酸的碳酸钡沉淀,硫酸钡不溶于稀硝酸,所以到C点后沉淀不在减少。

 名校课堂系列答案
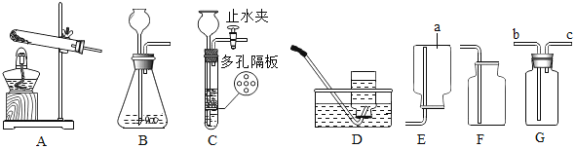
名校课堂系列答案【题目】对比实验是实验探究的重要方法,下列对比实验设计能实现相应实验目的的是
选项 | 实验目的 | 实验设计 | 选项 | 实验目的 | 实验设计 |
A | 探究温度对分子运动快慢的影响 |
| B | 探究水对铁钉锈蚀的影响 |
|
C | 探究空气是燃烧的必要条件 |
| D | 探究CO2与水反生反应 |
|
A. A B. B C. C D. D
【题目】废铁屑的主要成分是铁,同时还有少量铁锈,动物饲料硫酸亚铁的生产工艺之一如下图所示
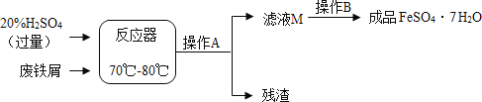
(1)写出在反应器中发生的化学反应方程式
①Fe2(SO4)3+Fe==3FeSO4;②_____;③_____
(2)滤液M中肯定含有的溶质的化学式是_____(填化学式)
(3)在实验室中完成操作A的玻璃仪器有玻璃棒、烧杯和_____
(4)滤液M经过操作B可得硫酸亚铁晶体(FeSO4·7H2O)
温度/℃ | 0 | 10 | 30 | 40 | 50 | 60 | 64 | 70 | 80 | 90 | |||
溶解度/g | 15.6 | 20.5 | 33.0 | 40.4 | 48.8 | 55.0 | 55.3 | 50.6 | 43.7 | 37.2 | |||
析出晶体 | FeSO47H2O | FeSO44H2O | FeSO4H2O | ||||||||||
根据上表,从滤液M得到硫酸亚铁晶体(FeSO4·7H2O)的最佳方案为:将M加热至_____℃,浓缩接近饱和后_____,再经过_____操作得到硫酸亚铁晶体
(5)将无水硫酸亚铁(FeSO4)隔绝空气加强热,生成产物有氧化铁和两种硫的氧化物,试写出该反应的化学方程式_____