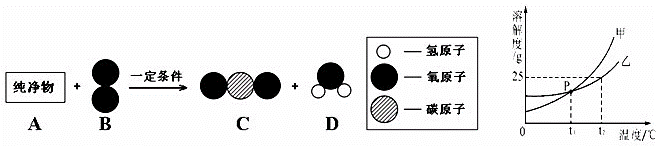题目内容
(1)溶解度可表示物质溶解性的大小.如图是甲、乙两种固体物质(均不含结晶水)的溶解度曲线.试回答下列问题:
①P点的含义是 .
②t2℃时,甲的溶解度 (填“<”“=”“>”之一)乙的溶解度.
③t2℃时,向100g水中加入30g乙物质的固体,发现全部溶解,一段时间后又有部分乙的晶体析出.你认为“全部溶解”的原因可能是 .
(2)已知纯净物A的相对分子质量为44,它可用作气体燃料.在一定条件下,将一定质量的A与160g B按如图所示充分反应,当B反应完全时,生成132gC和72gD.

请根据上述信息回答下列问题:
①上述过程中参加反应的A物质的质量是 g.
②写出上述反应的化学方程式 .
| (1)①溶解度曲线的交点表示该温度下两物质的溶解度相等; ②根据固体物质的溶解度曲线可以比较不同物质在同一温度下的溶解度大小; ③根据乙的溶解度随温度的升高而增大考虑; (2)根据质量守恒定律,可求A参加反应的质量;由“132gC和72gD”,结合模型图可推测C为二氧化碳,D为水,可以求出二氧化碳中的碳元素的质量,水中氢元素的质量,即A中各元素的质量比;已知A的相对分子质量为44和元素组成,可写出A的化学式,然后完成该反应的化学方程式. | |
| 解答: | 解:(1)①t1℃时甲、乙的溶解度相交于P点,表示该温度下两物质的溶解度相等; ②据溶解度曲线可知:t2℃时,甲的溶解度>乙的溶解度; ③乙的溶解度随温度的升高而增大,t2℃时,向100g水中加入30g乙物质的固体,发现全部溶解,一段时间后又有部分甲的晶体析出,说明开始溶解度大,最后溶解度变小,即乙固体溶于水可能放出热量,使温度升高,冷却后温度降低溶解度又变小,所以又析出晶体; (2)①由已知“将在一定条件下,将一定质量的A与160g B按如图所示充分反应,当B反应完全时,生成132gC和72gD”,根据质量守恒定律,则可求A参加反应的质量为:132+72﹣160=44克; ②结合模型图可推测C为二氧化碳,D为水,则“132gC中和72gD”二氧化碳中的碳元素的质量为132g× 故答案为: (1)①t1℃时甲、乙的溶解度相等;②>;③乙固体溶于水时放热;(2)①44g; ②C3H8+5O2 |

 状元及第系列答案
状元及第系列答案 同步奥数系列答案
同步奥数系列答案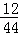 ×100%=36克,水中氢元素的质量为72g×
×100%=36克,水中氢元素的质量为72g×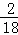 ×100%=8克;因为碳元素、氢元素都来自A,据反应前后元素的质量不变,可知A中氢、氧元素的质量分别是36g、8g,二者之和恰好是44g,说明A由碳元素和氢元素组成,故A中各元素的质量比m(C):m(H)=36:8,碳、氢原子个数比为:
×100%=8克;因为碳元素、氢元素都来自A,据反应前后元素的质量不变,可知A中氢、氧元素的质量分别是36g、8g,二者之和恰好是44g,说明A由碳元素和氢元素组成,故A中各元素的质量比m(C):m(H)=36:8,碳、氢原子个数比为: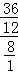 =3:8已知A的相对分子质量为44,则A的化学式为C3H8,故该反应的化学方程式是C3H8+5O2
=3:8已知A的相对分子质量为44,则A的化学式为C3H8,故该反应的化学方程式是C3H8+5O2  3CO2+4H2O
3CO2+4H2O