题目内容
【题目】铁是现代化学工业的基础,人类进步所必不可少的金属材料.
(1)看图1回答,铁元素的原子序数为 , 相对原子质量为 . 亚铁离子(Fe2+)的核外电子数为 , 质子数为 . 
(2)健康人体内,总量4~5g的铁元素主要以化合物形式存在,缺铁会患上 (填字母).
a.骨质疏松 b.甲状腺疾病 c.贫血症 d.侏儒症
(3)【实验一】兴趣小组通过图2实验研究铁的冶炼 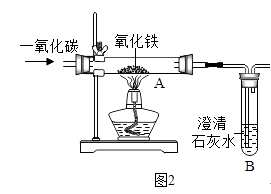
该装置的设计有一明显不当之处,你的改进方案是 .
(4)试写出一氧化碳和氧化铁在高温下生成铁的化学反应方程式;
(5)实验一段时间后,观察到B处澄清石灰水变;A处红棕色固体变为黑色,小明将所得的黑色固体物质放入足量的稀硫酸中,发现有少量气泡.写出反应的化学方程式 , 说明黑色固体物质(填字母). a.不含铁 b.一定全部是铁 c.含有铁
(6)【资料1】已知铁的氧化物均能逐步失去其中的氧,最终被还原为铁. Fe2O3 ![]() Fe3O4
Fe3O4 ![]() FeO
FeO ![]() Fe
Fe
【资料2】实验研究表明:该实验得到是四氧化三铁与铁粉的混合物
【实验二】研究后兴趣小组用图3实验研究实验一所得黑色粉末中单质铁的质量分数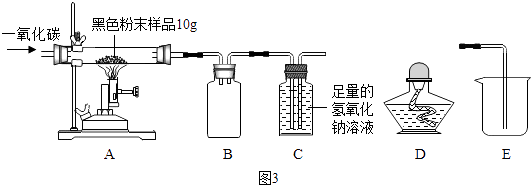
【资料3】氢氧化钠溶液和石灰水类似都可以与二氧化碳反应,但吸收能力比石灰水强
从安全与规范的角度考虑,装置C后面应连接(选填装置序号)
(7)铁与四氧化三铁的混合物10g充分反应后,玻璃管中剩余固体(单质铁)的质量为7.6g.请计算10g黑色粉末中单质铁的质量分数.
【答案】
(1)26;55.85;24;26
(2)c
(3)在尾导管口处放置一点燃的酒精灯(其他合理答案也可)
(4)Fe2O3+3CO ![]() 2Fe+3CO2
2Fe+3CO2
(5)浑浊;Fe+H2SO4=FeSO4+H2↑;c
(6)D
(7)解:设四氧化三铁的质量为x,由四氧化三铁和一氧化碳反应的化学方程式可知固体减少的质量就是四氧化三铁中氧元素的质量可知:
Fe3O4+4CO | 3Fe+4CO2 | 减少的质量 |
232 | 168 | 232-168=64 |
x | 10g﹣7.6g=2.4g |
![]()
x=8.7g
则混合物中铁的质量分数为: ![]() =13%
=13%
答:10g黑色粉末中单质铁的质量分数为13%.
【解析】解:(1)铁的原子序数为26,相对原子质量为55.85;在原子中原子序数=质子数=核外电子数,故铁原子有26个电子,形成亚铁离子时失去了2个电子,故亚铁离子还有24个电子但是质子数不变,故填:26;55.85;24;26;(2)元素在人体内主要是以化合物的形式存在的,缺铁易患贫血,这里的铁指元素,故填:c;(3)一氧化碳有毒,散失到空气中会污染空气,在尾导管口处放置尾气处理装置,故填:在尾导管口处放置一点燃的酒精灯(其他合理答案也可);(4)一氧化碳还原氧化铁,主要是利用CO的还原性,在高温下和氧化铁反应生成铁和二氧化碳,反应的化学方程式为Fe2O3+3CO ![]() 2Fe+3CO2 . 故填:Fe2O3+3CO
2Fe+3CO2 . 故填:Fe2O3+3CO ![]() 2Fe+3CO2;(5)产生的二氧化碳与氢氧化钙反应生成了碳酸钙白色沉淀和水,故填:浑浊; 铁能与稀硫酸反应生成硫酸亚铁和氢气,此现象说明黑色固体中含有铁,但不一定全部是铁.故填:Fe+H2SO4=FeSO4+H2↑;c;(6)尾气中含有有毒的一氧化碳气体,不能直接排放到空气中,需将其点燃处理,故填:D;
2Fe+3CO2;(5)产生的二氧化碳与氢氧化钙反应生成了碳酸钙白色沉淀和水,故填:浑浊; 铁能与稀硫酸反应生成硫酸亚铁和氢气,此现象说明黑色固体中含有铁,但不一定全部是铁.故填:Fe+H2SO4=FeSO4+H2↑;c;(6)尾气中含有有毒的一氧化碳气体,不能直接排放到空气中,需将其点燃处理,故填:D;
(1)根据元素周期表的信息以及离子形成过程来分析;(2)根据元素在人体内的存在形式以及铁元素与人体健康的关系来分析;(3)根据一氧化碳的毒性分析;(4)根据反应原理找出反应物、生成物、反应条件,根据化学方程式的书写方法、步骤进行书写;(5)根据二氧化碳的性质来分析;
根据铁的化学性质来分析;(6)根据尾气中含有一氧化碳来分析;(7)由混合物的质量和固体减少的质量根据四氧化三铁和一氧化碳反应的化学方程式可知固体减少的质量就是四氧化三铁中氧元素的质量,根据氧元素的质量从而求出四氧化三铁的质量进而求出混合物中铁的质量分数.

 名师伴你成长课时同步学练测系列答案
名师伴你成长课时同步学练测系列答案