题目内容
某同学在老师的指导下将足量金属锌与200g质量分数为24.5%的稀硫酸放入烧杯中充分反应,直到不再产生气体时,烧杯中仍有固体残余物.求:
(1)要配制200g质量分数为24.5%的稀硫酸,需要98%的浓硫酸的质量.
(2)反应生成氢气的质量.(有关反应的化学方程式为:Zn+H2SO4═ZnSO4+H2↑)
解:(1)设需要98%的浓硫酸的质量为x.
x?98%=200g×24.5%
x=50g
答:需要98%的浓硫酸50g.
(2)设反应生成氢气的质量为y.
200g×24.5%=49g
Zn+H2SO4═ZnSO4+H2↑
98 2
49g y
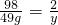
y=1g
答:反应生成的氢气的质量为1g.
分析:(1)根据溶液稀释前后溶质的质量不变进行解答;
(2)根据稀硫酸中溶质的质量求出氢气的质量进行解答.
点评:本题难度不是很大,主要考查了数据地分析及根据化学方程式进行计算,培养学生的分析能力和解决问题的能力.
x?98%=200g×24.5%
x=50g
答:需要98%的浓硫酸50g.
(2)设反应生成氢气的质量为y.
200g×24.5%=49g
Zn+H2SO4═ZnSO4+H2↑
98 2
49g y
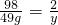
y=1g
答:反应生成的氢气的质量为1g.
分析:(1)根据溶液稀释前后溶质的质量不变进行解答;
(2)根据稀硫酸中溶质的质量求出氢气的质量进行解答.
点评:本题难度不是很大,主要考查了数据地分析及根据化学方程式进行计算,培养学生的分析能力和解决问题的能力.

练习册系列答案
 科学实验活动册系列答案
科学实验活动册系列答案
相关题目