题目内容
硝酸钾和氯化钠在不同温度下的溶解度如下表所示:
| 温度(℃) | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 100 |
| NaCl溶解度/g | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 | 37.8 | 38.4 | 39.0 | 39.8 |
| KNO3溶解度/g | 13.3 | 20.9 | 31.6 | 45.8 | 63.9 | 85.5 | 110 | 138 | 169 | 202 | 246 |
(1)硝酸钾溶液中的溶质为________.
(2)分析以上数据,可以得出结论,写出其中一个:
________.
(3)在60℃时,100g水中加入150g硝酸钾,充分搅拌后所得溶液的质量为________g.
(4)将30℃时的硝酸钾饱和溶液转变为不饱和溶液的一种方法是________,从氯化钠溶液中结晶出氯化钠的方法是________.
解:(1)一般所说的溶液就是指水溶液,硝酸钾溶液就是指水是溶剂,硝酸钾是溶质.
故答案为:硝酸钾;
(2)观察图表可知,0℃时,氯化钠的溶解度是35.7,硝酸钾的溶解度是13.3g,100℃时,氯化钠的溶解度是39.8g,硝酸钾的溶解度是246g,据此可知氯化钠的溶解度受温度变化影响不大;硝酸钾的溶解度受温度变化影响较大.
故答案为:氯化钠的溶解度受温度变化影响不大;硝酸钾的溶解度受温度变化影响较大;
(3)溶液的质量=溶质质量+溶剂质量,70℃时,硝酸钾的溶解度是138g,加入150g硝酸钾有一部分没有溶解,所以此温度下溶液的质量是:110g+100g=210g
故答案为:210;
(4)因为硝酸钾的溶解度随温度的上升而增大,要使30℃时的硝酸钾饱和溶液转变为不饱和溶液,可以升高温度或增加溶剂;因氯化钠的溶解度受温度的影响不大,我们可以将溶液加热蒸发,使溶液达到饱和后,在蒸发掉溶剂,溶质就会结晶析出.
故答案为:升温或加水;蒸发溶剂.
故答案为:(1)硝酸钾;
(2)氯化钠的溶解度受温度变化影响不大;硝酸钾的溶解度受温度变化影响较大;
(3)210;
(4)升温或加水;蒸发溶剂.
分析:(1)根据一般所说的溶液就是指水溶液,水是溶剂判断;
(2)观察图表,纵向对比对氯化钠和硝酸钾在相同温度下的溶解度,再横向对比氯化钠和硝酸钾在不同温度下的溶解度,然后得出结论.
(3)根据溶液的质量=溶质质量+溶剂质量计算;
(4)根据两种物质受温度影响的情况判断各自的方法.
点评:此题是对溶解度知识的考查,解题时只要抓住表格中相关溶解度信息进行分析即可,属基础性知识考查题.特别要注意(3)中,不要把没有溶解的硝酸钾加入溶液的质量中.
故答案为:硝酸钾;
(2)观察图表可知,0℃时,氯化钠的溶解度是35.7,硝酸钾的溶解度是13.3g,100℃时,氯化钠的溶解度是39.8g,硝酸钾的溶解度是246g,据此可知氯化钠的溶解度受温度变化影响不大;硝酸钾的溶解度受温度变化影响较大.
故答案为:氯化钠的溶解度受温度变化影响不大;硝酸钾的溶解度受温度变化影响较大;
(3)溶液的质量=溶质质量+溶剂质量,70℃时,硝酸钾的溶解度是138g,加入150g硝酸钾有一部分没有溶解,所以此温度下溶液的质量是:110g+100g=210g
故答案为:210;
(4)因为硝酸钾的溶解度随温度的上升而增大,要使30℃时的硝酸钾饱和溶液转变为不饱和溶液,可以升高温度或增加溶剂;因氯化钠的溶解度受温度的影响不大,我们可以将溶液加热蒸发,使溶液达到饱和后,在蒸发掉溶剂,溶质就会结晶析出.
故答案为:升温或加水;蒸发溶剂.
故答案为:(1)硝酸钾;
(2)氯化钠的溶解度受温度变化影响不大;硝酸钾的溶解度受温度变化影响较大;
(3)210;
(4)升温或加水;蒸发溶剂.
分析:(1)根据一般所说的溶液就是指水溶液,水是溶剂判断;
(2)观察图表,纵向对比对氯化钠和硝酸钾在相同温度下的溶解度,再横向对比氯化钠和硝酸钾在不同温度下的溶解度,然后得出结论.
(3)根据溶液的质量=溶质质量+溶剂质量计算;
(4)根据两种物质受温度影响的情况判断各自的方法.
点评:此题是对溶解度知识的考查,解题时只要抓住表格中相关溶解度信息进行分析即可,属基础性知识考查题.特别要注意(3)中,不要把没有溶解的硝酸钾加入溶液的质量中.

练习册系列答案
 双基同步导航训练系列答案
双基同步导航训练系列答案 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案
相关题目

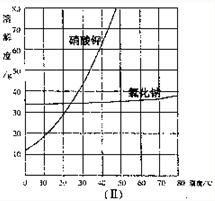
 下列数据是硝酸钾和氯化钠在不同温度时的溶解度.
下列数据是硝酸钾和氯化钠在不同温度时的溶解度.