题目内容
(2010?青岛模拟)某课外兴趣小组对一批铁样品(含有杂质,杂质不溶于水,也不与稀硫酸反应)进行分析,甲、乙、丙三位同学分别进行实验,其中只有一位同学所取用的稀硫酸与铁样品恰好完全反应.实验数据如下:| 甲 | 乙 | 丙 | |
| 烧杯+稀硫酸 | 250g | 200g | 200g |
| 加入的铁样品 | 9g | 9g | 14g |
| 充分反应后,烧杯+剩余物 | 258.7g | 208.7g | 213.7g |
(1)______同学所取用的稀硫酸与铁样品恰好完全反应;
(2)计算样品中铁的质量分数;
(3)所用稀硫酸的溶质质量分数.
【答案】分析:(1)甲、乙比较说明铁样品完全反应能产生0.3g氢气;乙、丙比较说明200g-75.4g=124.6g稀硫酸完全反应生成0.3g氢气,因此乙同学所取用的稀硫酸与铁样品恰好完全反应.
(2)由氢气的质量根据铁与硫酸反应的化学方程式可以计算出样品中铁的质量分数和稀硫酸中溶质硫酸的质量.
(3)由硫酸的质量可以计算出稀硫酸中溶质的质量分数.
解答:解:(1)甲、乙比较说明铁样品完全反应能产生0.3g;氢气;乙、丙比较说明200g-75.4g=124.6g稀硫酸完全反应生成0.3g氢气,因此乙同学所取用的稀硫酸与铁样品恰好完全反应.
(2)设样品中铁的质量分数为x,稀硫酸中硫酸的质量为y.
Fe+H2SO4=FeSO4+H2↑
56 98 2
9g?x y 200g+9g-208.7g=0.3g
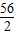 =
=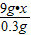 ,x≈93%
,x≈93%
(3)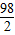 =
=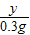 ,y=14.7g
,y=14.7g
稀硫酸中溶质的质量分数为
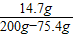 ×100%≈12%
×100%≈12%
答:(1)乙.
(2)样品中铁的质量分数为93%.
(3)所用稀硫酸的溶质质量分数为12%.
点评:本题主要考查含杂质物质的化学方程式计算和溶质质量分数的计算,难度较大.
(2)由氢气的质量根据铁与硫酸反应的化学方程式可以计算出样品中铁的质量分数和稀硫酸中溶质硫酸的质量.
(3)由硫酸的质量可以计算出稀硫酸中溶质的质量分数.
解答:解:(1)甲、乙比较说明铁样品完全反应能产生0.3g;氢气;乙、丙比较说明200g-75.4g=124.6g稀硫酸完全反应生成0.3g氢气,因此乙同学所取用的稀硫酸与铁样品恰好完全反应.
(2)设样品中铁的质量分数为x,稀硫酸中硫酸的质量为y.
Fe+H2SO4=FeSO4+H2↑
56 98 2
9g?x y 200g+9g-208.7g=0.3g
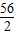 =
=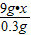 ,x≈93%
,x≈93%(3)
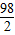 =
=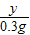 ,y=14.7g
,y=14.7g稀硫酸中溶质的质量分数为
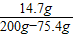 ×100%≈12%
×100%≈12%答:(1)乙.
(2)样品中铁的质量分数为93%.
(3)所用稀硫酸的溶质质量分数为12%.
点评:本题主要考查含杂质物质的化学方程式计算和溶质质量分数的计算,难度较大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目