题目内容
【题目】根据所学化学知识回答下列问题,能写化学方程式的请写出化学方程式。
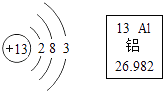
(1)某粒子结构示意图为 ![]() ,若该粒子带有1个单位负电荷,则X=。
,若该粒子带有1个单位负电荷,则X=。
(2)日常生活中使用硬水会带来许多麻烦,所以我们要学会区分硬水和软水,区分硬水和软水最简单的方法是。
(3)用含氢氧化铝的药物治疗胃酸过多的原理。
(4)稀硫酸的作用之一就是除铁锈,请写出这个原理。
(5)酒精是人们常用的一种燃料,其燃烧的化学方程式为。
(6)矿石是冶炼金属的原料,菱铁矿的主要成分是FeCO3 , 试计算FeCO3中Fe的质量分数为。
【答案】
(1)9
(2)加肥皂水
(3)Al(OH)3+3HCl=AlCl3+3H2O
(4)Fe2O3+3H2SO4=Fe2(SO4)3+3H2O
(5)C2H5OH+3O2 ![]() 2CO2+3H2O
2CO2+3H2O
(6)48.3%
【解析】离子是由原子的是电子形成的,失去电子时带正电荷,正电荷数等于失电子数,得电子时带负电荷,负电荷数等于得电子数。所以X=9;(2). 加肥皂水后,泡沫少、浮渣多的为硬水,反之,为软水; (3). 胃酸的主要成分是盐酸,氢氧化铝和盐酸反应生成氯化铝和水,方程式为:Al(OH)3+3HCl=AlCl3+3H2O (4). 铁锈的主要成分是氧化铁,和硫酸反应生成硫酸铁和水,方程式为Fe2O3+3H2SO4=Fe2(SO4)3+3H2O (5). 酒精燃烧生成二氧化碳和水,化学方程式为C2H5OH+3O2 ![]() 2CO2+3H2O (6).
2CO2+3H2O (6). ![]() ,FeCO3中Fe的质量分数为
,FeCO3中Fe的质量分数为 ![]() 48.3%
48.3%
故答案为:(1)9;(2)加肥皂水;(3)Al(OH)3+3HCl=AlCl3+3H2O;(4)Fe2O3+3H2SO4=Fe2(SO4)3+3H2O;
(5)C2H5OH+3O2 ![]() 2CO2+3H2O;(6)48.3%某粒子带一个单位负电荷,是原子得电子形成;硬软水的区分使用肥皂水;根据反应物、生成物和反应条件可写出方程式(注意方程书写的步骤和方法);化合物中某元素的质量分数等于相对原子质量乘以原子个数除以相对分子质量乘以百分之百
2CO2+3H2O;(6)48.3%某粒子带一个单位负电荷,是原子得电子形成;硬软水的区分使用肥皂水;根据反应物、生成物和反应条件可写出方程式(注意方程书写的步骤和方法);化合物中某元素的质量分数等于相对原子质量乘以原子个数除以相对分子质量乘以百分之百

 期末金牌卷系列答案
期末金牌卷系列答案 轻松课堂标准练系列答案
轻松课堂标准练系列答案