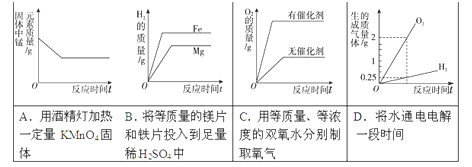
题目内容
【题目】(7分)为了分析生铁中铁的含量,某学习小组进行了实验研究:取6g生铁与10%的盐酸反应,并绘制了加入盐酸质量与放出气体质量的关系图(见下图)。(说明:生铁中杂质不溶于水,不与盐酸反应 )
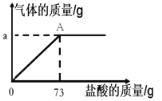
(1)实验中可观察到______________________。(写1条)
(2)铁完全反应用去盐酸的质量为 g。
(3)生铁中铁的质量分数为 (精确到0.1%)。
(4)A点表示的溶液的质量为多少?(写出求算过程)
【答案】(1)有气泡产生,溶液逐渐变为浅绿色;(2)73g;(3)93.3%;(4)78.4g.
【解析】(1)因为铁与稀盐酸反应生成氢气和氯化亚铁,所以实验中可观察到有气泡产生,溶液逐渐变为浅绿色;
(2)根据图示的信息可知,盐酸消耗73g时气体质量不再改变,所以说明铁完全反应用去盐酸的质量为73g;
(3)设生铁中铁的质量分数为x,生成氯化亚铁质量为y,生成氢气质量为z,参加反应的盐酸中溶质质量为:73g×10%=7.3g,
Fe + 2HCl = FeCl2+H2↑
56 73 127 2
x 7.3g y z
![]() x=5.6g y=12.7g z=0.2g
x=5.6g y=12.7g z=0.2g
![]() =93.3% 5.6g+73g-0.2g=78.4g
=93.3% 5.6g+73g-0.2g=78.4g
答:设生铁中铁的质量分数为93.3%,A点表示的溶液的质量为78.4g.
试题分析:根据铁与稀盐酸反应生成氢气分析;根据图示信息盐酸消耗73g时气体质量不再改变分析;根据盐酸溶液质量和溶质质量分数计算参加反应的溶质质量,据此计算反应的铁、生成氢气的质量及生铁中铁的质量分数;最后根据盐酸溶液质量、反应掉的铁的质量及生成氢气的质量计算反应后A点溶液的质量.
考点:合金的组成和性质;混合物中纯净物的质量分数的计算;根据化学方程式的计算

练习册系列答案
 激活思维优加课堂系列答案
激活思维优加课堂系列答案 活力试卷系列答案
活力试卷系列答案
相关题目