题目内容
【题目】某化学兴趣小组在实验室配制一定溶质质量分数的稀盐酸,并用其测定某氢氧化钠溶液的溶质的质量分数. 实验一:37%的浓盐酸(密度为1.19g/mL)、氢氧化钠溶液、蒸馏水、量筒、细口瓶等.
实验步骤:
①计算:配制74g质量分数为10%的稀盐酸,需要37%的浓盐酸的体积为mL(精确到0.1mL,下同);需要蒸馏水的体积为mL(水的密度为1.0g/mL).
②量取:用量筒分别量取相应的浓盐酸和蒸馏水.
③ .
④装瓶并贴上标签.
实验二:用上述配制的稀盐酸加入到20g某氢氧化钠溶液中,溶液pH的变化情况如图所示.试计算该氢氧化钠溶液中溶质的质量分数.(在答题卡上写出计算过程)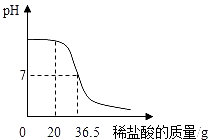
【答案】16.8;54;混匀;20%
【解析】解:实验一:根据配制前后溶液中的溶质质量不变,设需要37%浓盐酸溶液的质量为x,则有:74g×10%=37%×x,解得x=20g,则需要37%浓盐酸溶液的体积为 ![]() ≈16.8mL,需要水的质量为74g﹣20g=54g,即需要54mL水,在实验室用浓硫酸配制稀硫酸的主要步骤有:计算、量取浓硫酸和水,然后混匀、冷却至室温装瓶并贴上标签. 解:设参加反应的氢氧化钠溶液中溶质的质量为x.
≈16.8mL,需要水的质量为74g﹣20g=54g,即需要54mL水,在实验室用浓硫酸配制稀硫酸的主要步骤有:计算、量取浓硫酸和水,然后混匀、冷却至室温装瓶并贴上标签. 解:设参加反应的氢氧化钠溶液中溶质的质量为x.
NaOH+ | HCl=NaCl+H2O |
40 | 36.5 |
x | 36.5g×10% |
![]()
x=4g
氢氧化钠溶液中溶质的质量分数为 ![]() ×100%=20%
×100%=20%
答:氢氧化钠溶液中溶质的质量分数为20%.
故答案为:实验一:16.8;54;混匀
实验二:氢氧化钠溶液中溶质的质量分数为20%.
实验一:用水稀释浓溶液成稀溶液的过程中,溶质的质量不变,溶液的质量=溶液的密度×溶液的体积,据此列等式计算,并据配制溶液的步骤分析解答.
实验二:根据盐酸与氢氧化钠反应生成氯化钠和水,利用恰好完全反应时所消耗氢氧化钠的质量,计算反应氢氧化钠溶液中溶质的质量分数.

【题目】下列物质符合图中转化关系的是( )
选项 | 甲 | 乙 | 丙 | 转化关系图 |
A | Fe | Cu | Ag |
|
B | CaCO3 | Ca(OH)2 | CaCl2 | |
C | NaCl | NaNO3 | NaOH | |
D | Fe2O3 | H2O | O2 |
A.A
B.B
C.C
D.D
