��Ŀ����
����Ŀ����һ����ɫ������ܺ�̼���ơ������ơ��Ȼ��ء����ᱵ�����������е�һ�ֻ��֡�ij��ѧ��ȤС��Ϊ̽����ɷ���������ʵ�飺
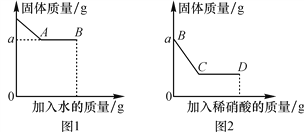
��.ȡ�����������ձ��У���ˮ�����Ͻ��裬�ձ��ڹ�������������ˮ�������ı仯��ͼ1��ʾ��
��.ȡ����B��ʱ����Һ���Թ��У��μӷ�̪��Һ����̪��Һ����ɫ��
��.�������ձ��еμ�ϡ���Ტ���Ͻ��裬�ձ��ڹ�������������ϡ����������ı仯��ͼ2��ʾ��
��ش��������⣺
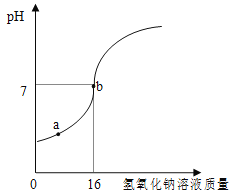
��1��BC�οɹ۲쵽��������____________________________����C��DҺ���pH________����������������С����������������
��2��ԭ��ɫ������һ������____________________________�����ܺ���________________��
��3��D��ʱ����Һ��һ�����е�������____________________��
��4��Ϊ��һ��̽���ð�ɫ����ijɷ֣�����ͬѧȡ����ԭ������Ʒ���Թ��У�������ˮ�ܽ⣬��______________________�����ˣ�������Һ�м�____________________���۲�����
���𰸡� ���岿���ܽ⣬�����ݲ��� ��С ̼���ơ������ơ����ᱵ �Ȼ��� �����ơ����ᱵ������ ����ϡ���� ��������Һ
��������ͼ1�м�����ˮ�������������ټ��٣�˵���������ԵĹ��塣ȡ����B��ʱ����Һ���Թ��У��μӷ�̪��Һ����̪��Һ����ɫ������Һ���Լ��ԣ���ɫ�����в������������ơ�ͼ2�м���ϡ���ᣬ���岿�ּ��٣����ٵĹ����Ƿ�Ӧ���ɵ�̼�ᱵ�����ʣ��Ĺ����Ƿ�Ӧ���ɵ����ᱵ����1��BC�εķ�Ӧ��BaCO3+2HNO3==Ba(NO3)2+H2O+CO2��,�ʿɹ۲쵽�������ǹ��岿���ܽ⣬�����ݲ�������C��Dϡ����������������࣬��Һ���������ǿ��pH��С����2����ǰ����ƶϿ�֪ԭ��ɫ������һ������̼���ơ������ơ����ᱵ�����ܺ����Ȼ��ء���3��D��ʱ����Һ��һ�����е����������ɵ������ơ����ᱵ��ʣ������ᡣ��4��Ϊ��һ��̽���ð�ɫ����ijɷ֣���ȷ���Ȼ����Ƿ���ڣ��Ȼ���������������Ӧ���ɲ�����ˮ���Ȼ�������������Ȼ����������ڣ���˵���Ȼ��ش��ڡ�

����Ŀ�����л�ѧ�У�����ѧϰ����ͼ���кͷ�Ӧ��ʵ����H++OH���TH2O����ͼ����������ʵ�ʲμӷ�Ӧ�����ӷ�������ʾ��Ӧ��ʽ�ӽ����ӷ���ʽ��
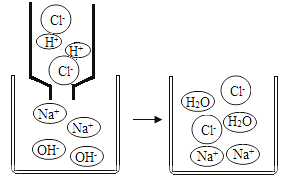
���ӷ���ʽ����дһ�㰴���²��裺����Na2SO4��BaCl2��ӦΪ����
��д��Na2SO4��BaCl2��Ӧ�Ļ�ѧ����ʽ�� ��
����������ˮ����������д��������ʽ�������ܵ����ʡ������ˮ�����û�ѧʽ��ʾ����������ʽ�ɸ�д�ɣ�2Na++SO42��+Ba2++2Cl���TBaSO4��+2Na++2Cl����
��ɾȥ����ʽ���߲��μӷ�Ӧ�����ӣ�Ba2++SO42���TBaSO4����
����鷽��ʽ���߸�Ԫ�ص�ԭ�Ӹ����͵�������Ƿ���ȡ�
��ش�
��1�����и����е����ӣ���pH=3��ˮ��Һ���ܴ���������� ��
A��Na+��Mg2+��Cl����SO4 2�� | B��Na+��K+��Cl����OH�� |
C��Na+��Cu2+��Cl����SO42�� | D��Na+��K+��Cl����CO32�� |
��2��д��ϡ�������ʯ��ʯ����������Ӧ�����ӷ���ʽ ��
��3��д��һ�������ӷ���ʽMg+2H+�TMg2++H2�����Ӧ�Ļ�ѧ����ʽ ��
��4���ᡢ�����ˮ��Һ�з����ĸ��ֽⷴӦʵ���Ͼ������ֻ���������Һ����������ӵķ�Ӧ��ֻҪ�߱��������������������� ���ɣ���Ӧ���ܷ�����