��Ŀ����
����ռ������Ҫ�Ļ���ԭ�ϡ�
(1)������ͼ��ʾװ�ÿɼ��֤��������̼���ռ���Һ�����˷�Ӧ����A��B���ӣ���ֹˮ�У�����ͷ�ι��е�Һ�強����ƿ����ʱ��ʵ��������_____,��Ӧ�Ļ�ѧ����ʽ_____��
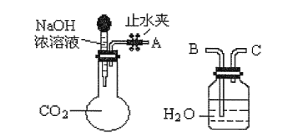
(2)��100mLһ����������������NaOH��Һ��ͨ����һ����CO2����ַ�Ӧ��õ���ҺA,��һ��������ʹ��ҺA�е����ʽᾧ�������õ������İ�ɫ���塣�����ʵ��ȷ�ϸð�ɫ����ijɷ֡�
������������衣
����1:�ð�ɫ����ΪNaOH��Na2CO3;
����2:�ð�ɫ����Ϊֻ��Na2CO3;
����3:�ð�ɫ����Ϊ_____
����4:�ð�ɫ����Ϊֻ��NaHCO3;
�ڻ��ڼ���1,���ʵ�鷽������ʵ�飬֤������ijɷ���NaOH��Na2CO3����֪BaCl2��Һ�����ԣ���д��ʵ�������Ԥ������ͽ��ۣ����б����еIJ�����Բ�����������ѡʵ���Լ�������������ˮ��HCl��Һ��BaCl2��Һ��Ba(OH)2��Һ��ʯ����Һ����̪��Һ���Թܡ���ͷ�ιܡ�����װ�á�
ʵ����� | Ԥ������ͽ��� |
����1:_____ | _____ |
����2:_____ | _____ |
����3:_____ | _____ |
�±��г��˳�ȥ�����������������ʵķ�����������ȷ����
��� | ���� | ���� | ��ȥ���ʵķ��� |
A | NaOH ��Һ | Na2CO3 | ��������ϡ���������ٲ������� |
B | KCl ���� | MnO2 | ��������ˮ���ܽ⡢���ˡ�ϴ�ӡ����� |
C | CaCl2 ��Һ | ϡ���� | �������̼��Ʒ�ĩ������ |
D | KC1 ��Һ | K2SO4 | �������� Ba(NO3)2 ��Һ������ |
A. A B. B C. C D. D
��(Te)����Ϊ���ִ���ҵ���������˼�����ά����,�����˼��漣����������ʵ����ģ����ȡ�ڵ�һ��ʵ���ǣ�ȡij��������(TeOSO4)��Һ����ƿ��,��������NaCl,���ȵ�һ���¶�,����ͨ��SO2������Ӧһ��ʱ�䣬���˵õ����ڡ�
(1)��Ӧ�ķ���ʽΪ��TeOSO4+2SO2+3X�TTe��+3H2SO4��X�Ļ�ѧʽΪ______.
(2)Ϊ̽����ýϸߴ��ڳ����ʵķ�Ӧ����,ij�о�С���ڿ���NaClŨ�Ⱥ�SO2���������������,�ı䷴Ӧ�������������Ա�����,����������������е����ݻش�
ʵ�� | �¶�/�� | ��Ӧʱ��/h | ��ȷ������/% |
a | 65 | 3.0 | 65.0 |
b | 80 | 3.0 | 98.9 |
c | 80 | 2.0 | 98.9 |
d | 90 | 2.0 | 97.0 |
��Ϊ�˵õ��ϸߵĴ��ڳ����ʣ���ѵķ�Ӧ������_____.
��Ϊ�������豸����Ч�ʺͽ�Լ��Դ,�ɽ�һ���Ż���Ӧ�����ⶨ���ڳ����ʡ�������ƶԱ�ʵ��,ѡ��ķ�Ӧ������������_____(��ѡ��).
A 80�桢1.5h B 80�桢2.5h C 70�桢2.0h D 95�桢2.0h.
ij��˾������������ѩ���ijɷ�����ˮCaCl2���������Ȼ��ƣ�Ϊ�ⶨ��ѩ�����Ȼ��Ƶĺ�������ѧ��ȤС���ͬѧ��ȡ����Ʒ12g����ˮ����ܽ⣬�õ���Һ50g��Ȼ��ȡһ������������̼������Һ100gƽ������μ��룬�����ʵ�����ݼ���������������ݲ������йؼ��㡣
������ | 1 | 2 | 3 | 4 | 5 |
����̼������Һ������/g | 20 | 20 | 20 | 20 | 20 |
���ɳ���������/g | 2.5 | x | 7.5 | 10 | 10 |
��1���ϱ���x����ֵΪ_____����_____�μ����̼�������Ȼ���ǡ����ȫ��Ӧ��
��2����Ʒ���Ȼ��Ƶ����������Ƕ���_____��
��3��ǡ����ȫ��Ӧʱ���ˣ����ò�������Һ���������������Ƕ���_____��



