��Ŀ����
����Ŀ��ij��ѧС��Ϊ�ⶨһƿʧȥ��ǩ����������������������ֳɼס������飬�ֱ��ò�ͬ�ķ������вⶨ�� ʵ����ƣ�
���飺ȡ����̼��Ʒ�ĩ5g���ձ��У�����20g��������Һ����ַ�Ӧ���ˡ�ϴ�ӡ����������ʣ�����3g��
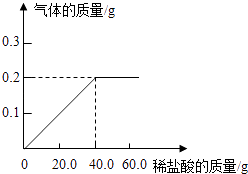
���飺ȡ����̼��Ʒ�ĩ5g����ƿ�У���20g��������Һ�����Һ©�������òⶨ����������̼�������20�桢������ѹ����������Ũ�ȣ�װ��ʾ��ͼ��ͼ��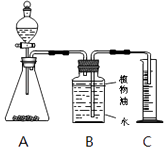
���ݴ�����
��1�������ü������ݼ�������������������������д��������̣�
��2�������������С�ڼ��飮�������ʵ���Եõ���ͬ�����������Ͳ������������ܵ�ԭ��������������ţ��� �ٲ�����ˮ���������������������
��B��C֮��ĵ�����ʵ��ǰ��ˮ��ʵ�����ˮ
��������ѹ��ͬʱ��������̼������Ӧ�����ˮѹ����Ͳ
�ܶ�����̼�����ܽ���A�з�Ӧ�����Һ�У�
���𰸡�
��1���⣺����̼��Ʒ�Ӧ����5g��3g=2g
��ϡ�������������Ϊx
CaCO3+ | 2HCl | = | CaCl2+ | H2O+ | CO2�� |
100 | 73 | ||||
2g | 20gx |
![]() =
= ![]()
x=7.3%
�𣺸������������������7.3%
��2���ۢ�
���������⣺��2�������ԭ�����ö�����̼��������������������������ȼ��������̼������Ϊm������ϡ�������������x������������Һ������Ϊn�� ��ϡ�������������Ϊx
CaCO3+ | 2HCl | = | CaCl2+ | H2O+ | CO2�� |
73 | 44 | ||||
nx | m |
![]() =
= ![]()
x= ![]()
���Կ���m������ƫСʱ���ᵼ���������������ƫС���ٲ�����ˮ�������������������������ᵼ���������������ƫ��B��C֮��ĵ�����ʵ��ǰ��ˮ��ʵ�����ˮ�������ڵ�ˮ�������˶�����̼��������ˮ��Ҳ�͵��¶�����̼������ƫ��Ҳ�͵����������������ƫ��������ѹ��ͬʱ��������̼������Ӧ�����ˮѹ����Ͳ��ѹ����ˮƫ�٣����Ӧ�Ķ�����̼ƫС��������̼������ȡ�����Ҳ�ı�������ˮ�������Ǿ�����ν�����˶��ٶ�����̼��Ҳ����ˮ�������Ӧ������̼������������ϡ�������������ƫС��
�ܶ�����̼�����ܽ���A�з�Ӧ�����Һ�У����ֶ�����̼��Aװ�����գ������B������ƫ�٣����Ӧ��ˮҲ��ƫС�����յ��������������ƫС��
��ѡ���ۢܣ�
�����㾫����������Ĺؼ�����������ݻ�ѧ��Ӧ����ʽ�ļ�������֪ʶ�����ո����ʼ�������=ϵ������Է�������֮�ȣ�

 ��У����ϵ�д�
��У����ϵ�д�����Ŀ����ƶԱ�ʵ���ǻ�ѧ����Ҫ���������жԱ�ʵ�鲻�ܴﵽĿ���ǣ� ��
��� | A | B | C | D |
ʵ����� |
|
|
|
|
ʵ��Ŀ�� | ̽��ͬ�������ڲ�ͬ�ܼ��е��ܽ��� | ̽�����ӵ��˶� | ̽������������� | ̽��CO2��NaOH��Һ�ܷ�����Ӧ |
A.A
B.B
C.C
D.D