题目内容
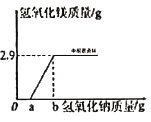
【题目】20g硫酸镁溶液中混有少量硫酸,往该溶液中滴加足量氢氧化钠溶液,充分反应后得到2.9g氢氧化镁沉淀。沉淀的质量变化如图所示。相关反应的化学方程式为MgSO4+2NaOH=Mg(OH)2↓+Na2SO4
(1)求20g溶液中硫酸镁的质量分数__________。
(2)氢氧化钠的质量≤a g时,反应不产生沉淀,其原因是_________。
【答案】30% 其原因是:结合图象可知,当氢氧化钠的质量≤ag时,硫酸未反应完,硫酸会与氢氧化镁沉淀反应,所以沉淀无法存在
【解析】
向硫酸和硫酸镁的混合溶液滴加氢氧化钠溶液,硫酸、硫酸镁都可与氢氧化钠发生反应,由于硫酸的存在,加入氢氧化钠不能直接生成沉淀,待硫酸反应完才能产生氢氧化镁沉淀;所以图象记录数据中,加入不大于ag氢氧化钠溶液时产生沉淀的质量为0;而在加入氢氧化钠溶液不小于bg时,产生沉淀的质量均为2.9g,说明硫酸镁已完全反应,;根据硫酸镁与氢氧化钠反应的化学方程式,由沉淀氢氧化镁的质量可计算混合溶液中硫酸镁的质量从而可计算出硫酸镁的质量分数。
解:(1)设20g溶液中硫酸镁的质量为x。

![]()
x=6g
20g溶液中硫酸镁的质量分数=![]()
答:20g溶液中硫酸镁的质量分数为30%
(2)结合图象可知,当氢氧化钠的质量≤ag时,硫酸未反应完,硫酸会与氢氧化镁沉淀反应,所以沉淀无法存在。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目