题目内容
为检查某石灰石样品中碳酸钙的纯度,取该样品12g放入烧杯中,再向烧杯中加入35g稀盐酸,恰好完全反应(杂质不参加反应),反应后烧杯中剩余固体物质共42.6g,
(1)反应生成CO2的质量为 g;
(2)石灰石样品中碳酸钙的质量分数.
【答案】
(1)4.4g (2)83.33%
【解析】
试题分析:(1)恰好完全反应时放出二氧化碳的质量为12g+35g﹣42.6g═4.4g;故填:4.4;
(2)设生成4.4gCO2需要碳酸钙的质量为x
CaCO3+2HCl═CaCl2+H2O+CO2↑
100 44
x 4.4g
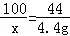
x=10g
 ×100%═83.33%
×100%═83.33%
答:石灰石样品中碳酸钙的质量分数为83.33%.
考点:根据化学反应方程式的计算.
点评:根据化学方程式进行计算时,只能使用纯净物的质量进行计算,而不能把混合物的质量直接代入化学方程式进行计算.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目