��Ŀ����
����Ŀ�������������������뿪�����ʡ���ȤС��������о����£�
I.�������Ʊ���
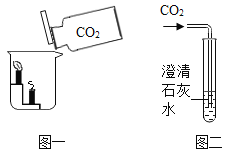
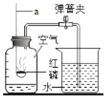
��1��д��ͼ���б�����������ƣ���_________����_________��
��2��д����ѧ��Ӧ����ʽ______��ͼ��װ��һ�����ԵĴ�����_________��
II.�������ռ���
[ʵ��1]�������ſ������ռ��������������ڼ���ƿ�ڴ�����ľ����ȼʱֹͣ�ռ����ⶨƿ�������ĺ������ظ�ʵ��3�Ρ�
[ʵ��2]�������ſ������ռ��������������ڼ���ƿ�ڴ�����ľ����ȼ�����ռ�40�룬�ⶨƿ�������ĺ������ظ�ʵ��3�Ρ�
[ʵ��3]����ˮ���ռ��������ⶨƿ�������ĺ������ظ�ʵ��3�Ρ�
ʵ������:
ʵ��1 | ʵ��2 | ʵ��3 | |||||||
�������������(%) | 79.7 | 79.6 | 79.9 | 88.4 | 89.0 | 87.9 | 90.0 | 89.8 | 89.3 |
������ƽ���������(%) | 79.7 | 88.4 | 89.7 | ||||||
���ݷ�����
��3����ʵ��1��2��֪���������ſ������ռ�����ʱ��Ϊ���õ���������������ɲ�ȡ�Ĵ�ʩ��______��
��.���֣������ǵ�ľ���ڲ�����������Ҳ�Ḵȼ��Ϊ���ҵ���ʹ��������ǩ��ȼ������������Сֵ�����ǽ���������̽����


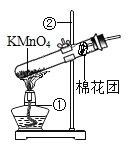
��1�������ʵ�飩С�����������ͼ��װ��,Բ����ƿ�з�������ͭ��Һ������ͭ����ˮ�Ļ�����Ŀ���Ǣ�____����____��д����ƿ�еĻ�ѧ��Ӧ����ʽ___��
��ʵ���о�����һ��ʵ�飺ȡ3ֻ����ƿ,���Ϊ�٢ڢۣ��ֱ�װ��15%��30%��45%��ˮ�����ϸDz�Ƭ������ˮ���С�������____�ų����ܿ����뼯��ƿ�����е�ˮȫ���ų�������ͬ��3֧��������ǩ�ֱ�����~�ۺ�ƿ�У���¼ʵ������õ�һ��ʵ�������С�������˵ڶ���ʵ�飬����¼ʵ����������ʵ�����ݺ����������
��2����������ʵ��������㣺ʹ�����ǵ�ľ����ȼ��С�����ĺ�������ʱ����ƿ�������������������Ӧ����____%������������������
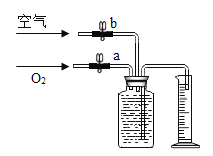
��3��Ϊ�˲ⶨ��ʹ�����ǵ�ľ����ȼʱ���������Ũ�ȣ�����С���ͬѧ���ֽ�����ʵ��̽����������Ƶ�ʵ�鷽�����Ƚ������Ϳ�������ͬ��������ռ��ڼ���ƿ��ռ������װ����ͼ���ռ�����ķ����ǣ���150mL����ƿ��װ��ˮ�������������رջ���b������aͨ����������ƿ���ˮ����������Ͳ�ڵ�ˮ�ﵽ�趨������������رջ���a��Ȼ�����bͨ���������ƿ���ˮȫ��������Ͳ����Ҫ�ռ�һƿ���������������ԼΪ60%�����壬��ֹͣͨ������ʱ��Ͳ��ˮ�����ԼΪ____����ʾ���������������������ԼΪ1/5��
A 25mL B 40mL C 60mL D 75mL
���𰸡��ƾ��� ����̨ ![]() �Թܿ�δ��������б ��ȡ�ӳ��ռ�ʱ�� �ӿ��������ķֽ����� ϡ����������Һ
�Թܿ�δ��������б ��ȡ�ӳ��ռ�ʱ�� �ӿ��������ķֽ����� ϡ����������Һ 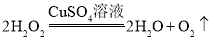 ������������ 49% D
������������ 49% D
��������
�⣺I.�������Ʊ�����1����ͼ��֪�����پƾ��ƣ���������̨��
��2������������ȷֽ���������غͶ������̺���������Ӧ�Ļ�ѧ��Ӧ����ʽΪ��![]() �����ȸ������ʱ���Թܿ�Ҫ��һ�������Է�ֹ������ط�ĩ���뵼�ܣ����������ʱ���Թܿ�Ҫ��������б���Է�����ˮ����ʹ�Թ�ը�ѣ�
�����ȸ������ʱ���Թܿ�Ҫ��һ�������Է�ֹ������ط�ĩ���뵼�ܣ����������ʱ���Թܿ�Ҫ��������б���Է�����ˮ����ʹ�Թ�ը�ѣ�
II.�������ռ�����3������ʵ��1��2�IJ�����֪��ʵ��2�ӳ��������ռ���ʱ�䣬�Ӷ�ʹƿ�������������������������������������õ�����������������Բ�ȡ�ӳ��ռ�ʱ��Ĵ�ʩ��
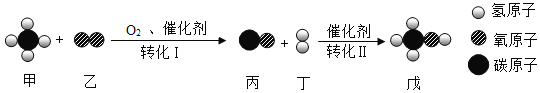
��.���֣���1��[���ʵ��]����ͭ��Һ���Լӿ��������ķֽ����ʣ�ͬʱ����ˮϡ����������Һ����ѧ��Ӧ����ʽΪ��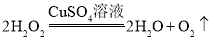 ��
��
[ʵ���о�]��һ��ʵ�飺ȡ3ֻ����ƿ�����Ϊ�٢ڢۣ��ֱ�װ��15%��30%��45%��ˮ�����ϸDz�Ƭ������ˮ���У����������������ȷų����ܿ����뼯��ƿ�����е�ˮȫ���ų���
��2����ͼ�п�֪������������������ﵽ35%ʱ�������ǵ�ľ����ȼ����ʱ������ռ65%�����Կ���������������Ϊ��65%��21%��14%�����Դ�ʱƿ�ڹ��������ķ���Ϊ��14%+35%=49%��
��3������������Ϊ150mL��60%=90mL������������ǣ�150mL-90mL=60mL������������ǣ�60mL��![]() =75mL����ôֹͣͨ������ʱ��Ͳ��ˮ�����ԼΪ��150mL-75mL=75mL��
=75mL����ôֹͣͨ������ʱ��Ͳ��ˮ�����ԼΪ��150mL-75mL=75mL��

 ���ʿ��ÿ��ֳɳ�ϵ�д�
���ʿ��ÿ��ֳɳ�ϵ�д�����Ŀ��������������������ı�����Դ�������ɷֵķ�����ʵ�����˺ܳ�ʱ����о����˽�������֪ʶ������Ҫѧ�ᱣ���������������졣
(1)�����к�����ǰ��λ������������____(������)��
(2)�����ɷֵIJⶨ��
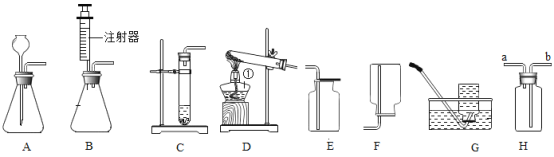
���ڶ��ٶ���ǰ���������ù�(ˮ��)�ö����ķ����о��˿����ijɷ�(ʵ��װ����ͼ)��ʵ����ѡ��ʹ�ù����ŵ���____��
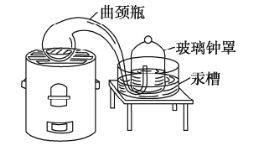
A ʵ�������û����Ⱦ
B �ڹ�������Һ������
C ���ɵĻ�������ȷֽ����ܵõ���������
D �ܽ��ܱ�װ���ڿ����е����������ľ�
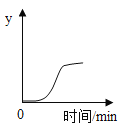
���������ǿ�������ͼ��װ�òⶨ�����������ĺ���������ִ���������������ù���������������ѹǿ���¶ȡ�����Ũ�ȵı仯������ͼ����ʾ��
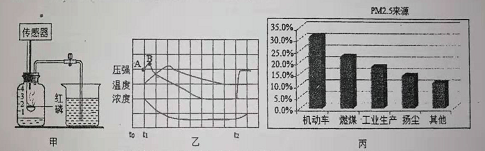
��t2ʱ��ֹˮ�У����ռ���ƿ��ˮƽ���Լ�������̶�_____����
�ڽ�����ߣ�����AB������ѹǿ�仯��ԭ����_____��
(3)�����ı���
��ͼ����ij��PMs��Դ�ֲ�ͼ���ݴˣ����д�ʩ�Լ���PM1sЧ������Ե���_____��
A ��������������
B �÷�����̫���ܷ������ȼú����
C ���ٹ�ҵ�����ж�����̼���ŷ�
�ڳ�������PM2.5�⣬����Ҳ���ڿ�����Ⱦ�����_____��
A ����
B һ����̼
C ��������
D PM10
(4)ʵ�鷴˼����̽��:
��ʵ��̽��1�����ú��ײⶨ��������������ʱ��ʹ������Ũ�ȴ�������÷�Ӧ��װ��������Ũ��Ϊ8.85����ʵ�����Ƚϴ�����С��������˿�����ʵ��(װ������ͼ1)�ⶨ����������ͨ��7���õ����ݼ�������������ĺ���Ϊ19.13����
�����������ۣ����ú���ȼ�յķ�����ȣ�����˿����ķ����ⶨ����Ҫ�ŵ㼰ԭ��:____��
��ʵ��̽��2��̽��1ʵ��ʱ��ϳ���Ϊ�˼ӿ췴Ӧ���ʣ�С��ͨ���������ϣ��������ۡ�̿�ۡ��Ȼ��Ƶ������ֽ�����ʵ��(װ������ͼ2)��8���Ӻ��õ��������:
ʵ��ǰ����� | ʵ������� | |
����ƿ�ڿ��� | �ձ�������ˮ | �ձ���ʣ������ˮ |
131mL | 90.0mL | 63.6mL |
��������������������______������������һλС����
(5)ͨ�����������ⶨ����������������ʵ����Կ�����ѡ��____(����������)����ʵ�飬�ɽ�Ϊ���ٵ����ʵ�鲢��Сʵ����

����Ŀ��ͨ��������ˮ�ķе���100�棬����ѹǿ����ˮ�ķе�������ߡ���ͼ���о�ˮ�е�����ѹ�仯��ʵ�顣�ر�ֹˮ�У����Ӻ�װ�ã� �ٽ�Һ�� A�����Թܢ��У����ӣ��Թܢ��ڵ�ˮ���̷��ڡ���Һ��A������B����Ͽ�����
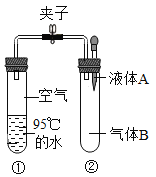
��� | A | B | C | D |
Һ��A | ˮ | ˮ | ʯ��ˮ | ˮ |
����B | ���� | ���� | ������̼ | ���� |
A.AB.BC.CD.D