题目内容
【题目】海洋是地球上最大的储水库,浩瀚的海洋蕴藏着丰富的化学资源.
(1)目前世界上60%的镁是从海水中提取的.其主要步骤如下:
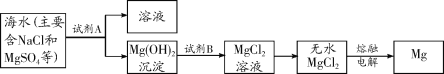
①提取Mg的过程中,试剂A可以选用 ,试剂B选用 ,由无水MgCl2制取Mg的基本反应类型为 .
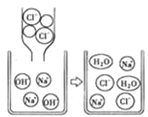
②分离出Mg(OH)2后的NaCl溶液中还含有CaCl2、Na2SO4等杂质,为了获得NaCl溶液,在分离后的溶液中依次加入过量的BaCl2溶液、Na2CO3溶液,过滤,再向滤液中加入适量盐酸.实验中加入过量BaCl2溶液是为了除去 ;加入过量Na2CO3溶液的目的是 .
(2)从海水中制得的氯化钠除可以食用外,还常用作工业原料生产相应的化工产品,如工业上利用氯化钠和水在通电条件下生成烧碱、氢气和氯气,试写出上述化学方程式:
【答案】(1)①氢氧化钠溶液(或氢氧化钙溶液) 稀盐酸 分解反应
②Na2SO4 除去CaCl2和BaCl2
(2)2NaCl+2H2O![]() 2NaOH + H2↑+Cl2↑
2NaOH + H2↑+Cl2↑
【解析】
试题分析:(1) ①要将MgSO4沉淀为Mg(OH)2,故试剂A可以选用氢氧化钠溶液(或氢氧化钙溶液);试剂B是将沉淀为Mg(OH)2转化为MgCl2,选用稀盐酸;由无水MgCl2制取Mg的基本反应类型为分解反应 ②实验中加入过量BaCl2溶液发生的反应:Na2SO4+BaCl2==BaSO4↓+2NaCl,故是为了除去Na2SO4;由于所加的加入BaCl2溶液是过量的,故过量Na2CO3溶液的目的是除去CaCl2和BaCl2;反应为:CaCl2+Na2CO3==CaCO3↓+2NaCl、BaCl2+Na2CO3==BaCO3↓+2NaCl
(2)氯化钠和水在通电条件生成烧碱、氢气和氯气,化学方程式为:2NaCl+2H2O![]() 2NaOH + H2↑+Cl2↑
2NaOH + H2↑+Cl2↑

【题目】某校化学兴趣小组,在实验室里用二氧化锰和浓盐酸在加热条件下制取氯气并进行有关氯气性质的实验探究(如图所示).

回答下列问题:
(1)从分液漏斗中加入的药品是__________
(2)从反应物的状态和反应条件考虑,装置A属于__________型气体发生装置。
(3)若进入装置D中的氯气是纯净干燥的,则装置B的作用是__________,装置C中盛有的溶液是__________。
(4)实验过程中,同学们看到装置D中“石蕊纸花”(用石蕊溶液染成的紫色的干燥纸花,下同)无明显变化,E中湿润的石蕊纸花先变红后褪色.对此,同学们产生了浓厚的兴趣,于是继续进行以下实验探究。
【查阅资料】Ⅰ.氯气(Cl2)是一种黄绿色的有毒气体,能溶于水(溶解性不大),并能与水反应:Cl2+H2O═HCl+HClO(次氯酸).
Ⅱ.氯气溶于水所得的溶液成为氯水,氯水除了具有消毒作用,还具有漂白作用.
【提出问题】氯水中的什么物质具有漂白作用?
【提出猜想】猜想1:氯水中的H2O具有漂白作用.
猜想2:氯水中的HCl具有漂白作用.
猜想3:氯水中的HClO具有漂白作用.
猜想4:氯水中的Cl2具有漂白作用.
【实验探究】
实验操作 | 实验现象 | 结论 |
①将石蕊纸花放入水中 | 石蕊纸花__________ | 猜想1不成立 |
②将石蕊纸花放入__________中 | 石蕊纸花变红但不褪色 | 猜想2不成立 |
③_________ | 石蕊纸花先变红后褪色 | 猜想3__________ |
【反思交流】①同学们一致认为,不用再做实验对猜想4进行探究,理由是:进行氯气性质的实验探究时,装置__________(填装置序号)的现象已证明了Cl2不具有漂白作用。
②钱程同学认为,由于氯气在水中的溶解性不大,用实验装置F中的蒸馏水吸收氯气效果不是很理想,于是将装置F中的蒸馏水换成了氢氧化钠溶液,则最终反应所得溶液中含有的盐类物质是__________。
【题目】甲、乙、丙三种物质只通过一步反应,不能实现如图所示的转化关系的是( )

甲 | 乙 | 丙 | |
A | C | CO | CO2 |
B | NaOH | Na2CO3 | Na2SO4 |
C | CuO | Cu | Cu(NO3)2 |
D | H2SO4 | H2 | H2O |
A.A B.B C.C D.D