题目内容
【题目】某兴趣小组在蒸发浓缩FeCl3溶液时发现有刺激性气味的气体生成,同时溶液中出现红褐色固体。小组同学对刺激性气味气体做出猜想:
(猜想)①Cl2 ②HCl ③_____。
(资料)①Cl2溶于水,形成的溶液显酸性,具有较强的漂白能力,能使石蕊溶液褪色。
②红褐色固体碱式氯化铁晶体的化学式为Fe2(OH)aClbxH2O,它在50℃时开始失去部分结晶水,在200℃完全分解为Fe2O3、H2O、HCl气体。
③浓H2SO4不吸收HCl气体。
(1)小组同学将生成的气体通入紫色石蕊溶液中看到_____现象,证明猜想②成立。
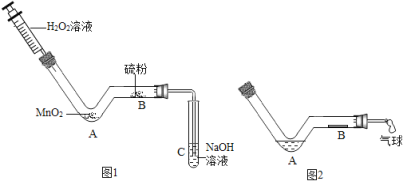
(2)为确定固体的组成,进行如下实验:
(实验)称取50.4g固体按下图进行实验。充分持续加热至200℃,最终得到Fe2O316.0g,B、C装置最终分别增重19.8g、14.6g。
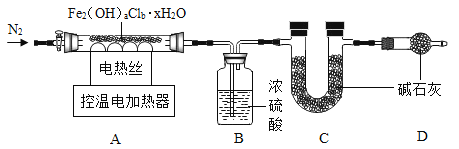
①加热前、后均需通入氮气,停止加热后通氮气的目的是防止倒吸和_____。
②晶体的化学式中a∶b=_____,若缺失D装置,实验测得的b值会_____(选填“偏大”、“偏小”或“不变”)。x=_____。
③请写出该红褐色固体在200℃时发生反应的总化学方程式_____。
【答案】Cl2和HCl 紫色的石蕊试液变红色,且不褪色 使产生的水蒸气和氯化氢气体分别被装置B、C完全吸收 1:2 偏大 12 Fe2(OH)2Cl412H2O![]() Fe2O3+11H2O+4HCl↑
Fe2O3+11H2O+4HCl↑
【解析】
[猜想]由质量守恒定律可知,该刺激性气味的气体可能是氯气或氯化氢气体或氯气与氯化氢气体的混合物;故填:Cl2和HCl;
(1)Cl2溶于水,形成的溶液显酸性,具有较强的漂白能力,能使石蕊溶液褪色。而氯化氢气体溶于水形成盐酸,盐酸能使紫色的石蕊试液变红色,且不褪色,证明猜想②成立;故填:紫色的石蕊试液变红色,且不褪色;
[实验]由质量守恒定律和题干信息可知,该物质分解为氧化铁、水和氯化氢气体。
①为了使产生的水蒸气和氯化氢气体分别被装置B、C完全吸收以及防止发生倒吸现象,在停止加热后要继续通一会儿氮气;故填:使产生的水蒸气和氯化氢气体分别被装置B、C完全吸收;
②装置C增重的质量即为生成氯化氢的质量,其中氯元素的质量为:14.6g×![]() ×100%=14.2g;
×100%=14.2g;
16.0g氧化铁中,铁元素的质量为:16.0g×![]() ×100%=11.2g
×100%=11.2g
则Fe2(OH)aClbxH2O中,铁元素与氯元素的质量比为:
112:35.5b=11.2g:14.2g
b=4
Fe2(OH)aClbxH2O中,铁元素显+3价,氢氧根显-1价,氯元素显-1价,根据化合物中各元素正负化合价的代数和为零可知:
(+3)×2+(-1)×a+(-1)×4=0
a=2
即:a:b=2:4=1:2
若缺失D装置,空气中的水蒸气和二氧化碳也会被装置C吸收,则实验测得的b值会偏大;
由化学反应前后,元素的种类与质量不变可知:
Fe2(OH)2Cl4xH2O--Fe2O3
288+18x 160
50.4g 16.0g
(288+18x):160=50.4g:16.0g
x=12
故填:1:2;偏大;12;
③Fe2(OH)2Cl412H2O在200℃时分解为氧化铁、水和氯化氢气体;故填:Fe2(OH)2Cl412H2O![]() Fe2O3+11H2O+4HCl↑。
Fe2O3+11H2O+4HCl↑。