题目内容
【题目】课本第二单元课后作业中有“寻找新的催化剂”的探究内容,实验中学探究小组据此设计了如下探究方案。
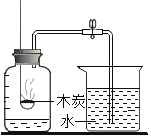
[提出问题]红砖粉末能否作为过氧化氢溶液分解的催化剂?如果能,效果如何?
[实验探究]
实验步骤 | 实验现象 | 实验结论及解释 |
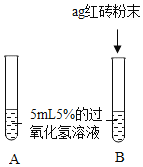
Ⅰ. | A中无明显现象,B中产生大量能使带火星木条复燃的气体 | ①产生的气体是_ ②___ |
II.向B试管中重新加入5%的过氧化氢溶液,反应停止后过滤、洗涤、干燥、称量滤渣 | ①又产生大量能使带火星木条复燃的气体 ②滤渣质量等于ag | 红砖粉末的__在反应前后均没有发生变化,能作过氧化氢分解的催化剂 |
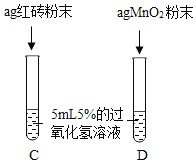
Ⅲ. | 两试管中均产生气泡且 __ | 红砖粉末的催化效果没有二氧化锰粉末好 |
[拓展应用]
己知CuSO4也可作为过氧化氢分解的催化剂。向101g 一定溶质质量分数的过氧化氢溶液中加入2gCuSO4粉末,充分反应后得到溶质质量分数为2%的溶液,则生成氧气__g。
【答案】O2 红砖粉末能改变过氧化氢分解速率 质量和化学性质 D 试管速率比C快 3
【解析】
Ⅰ、根据“B中产生大量能使带火星木条复燃的气体”可知,说明生成的气体是氧气;根据实验A、B的现象可知,红砖粉末能改变过氧化氢分解速率;
Ⅱ、红砖粉末能作催化剂,说明反应前后的质量化学性质不变;
Ⅲ、红砖粉末的催化效果没有二氧化锰粉末好,则D试管速率比C快;
[拓展应用]
CuSO4粉末在化学反应中用作催化剂,在化学反应前后质量不变,充分反应后得到溶质质量分数为2%的溶液,溶质的质量=2g;则溶液的质量=2g÷2%=100g,溶剂水的质量=100g-2g=98g,根据质量守恒定律可知:生成的氧气质量=101g-98g=3g。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
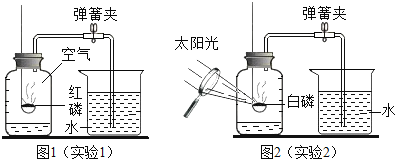
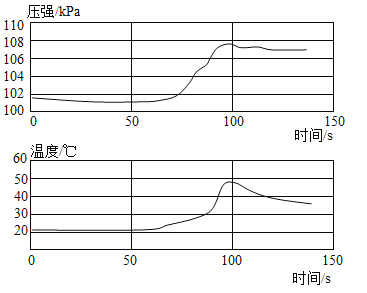
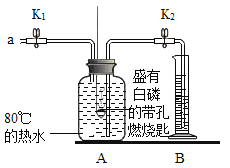
小学生10分钟应用题系列答案【题目】某同学要探究燃烧的条件利空气中氧气的含量,进行了如下实验。
(已知:白磷的着火点为40 °C)
实验装置 | 实验步骤及现象 |
| 步骤Ⅰ.检查装置的气密性,气密性良好。 步骤Ⅱ.将盛有足量白磷的带孔燃烧匙伸入A瓶中,白磷不燃烧。 步骤Ⅲ.向A瓶中加满80 C热水,塞紧瓶塞,白磷不燃烧。 步骤Ⅳ.打开K1、K2,从a口向A瓶中鼓入空气,待瓶中的液面低于燃烧匙底部时,关闭K1、K2。此时进入量筒B中水的体积为200 mL,观察到A瓶中的白磷燃烧。 |
(1)通过步骤___可知可燃物燃烧的条件之一是要有氧气。
(2)待装置冷却一段时间后,打开K2,如果观察到____,说明空气中氧气的体积约占1/5,若该实验测得空气中氧气的体积分数小于1/5,原因可能是___。
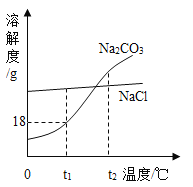
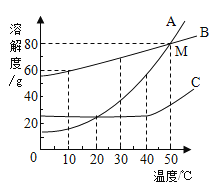
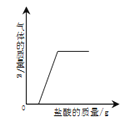
【题目】下列四个图像反映了对应实验过程中相关量的变化,其中错误的是
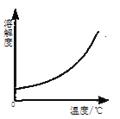
|
|
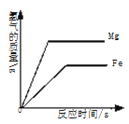
|
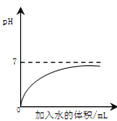
|
A.部分变质的NaOH溶液中滴加稀盐酸 | B.HCl气体的溶解度受温度影响的变化曲线 | C.等质量的Mg粉和Fe粉与足量相同浓度的稀盐酸反应 | D.硫酸溶液稀释过程中pH的变化曲线 |
A. A B. B C. C D. D