题目内容
(2011?河北区一模)在一烧杯中盛有溶质质量分数为10%的CaCl2溶液,然后向烧杯中逐渐滴入溶质质量分数为10%的Na2CO3溶液至不再生成沉淀为止,过滤后得到CaCO3沉淀10g,将滤液蒸发掉90g水后,求所得溶液中溶质的质量分数.
【答案】分析:反应后所得溶液为氯化钠溶液,所得溶液中溶质的质量分数 ×100%,其中氯化钠的质量可根据反应的化学方程式,由生成沉淀碳酸钙的质量计算求得;根据质量守恒定律,反应蒸发水后所得溶液质量=氯化钙溶液质量+碳酸钠溶液质量-生成沉淀的质量-蒸发水的质量.
×100%,其中氯化钠的质量可根据反应的化学方程式,由生成沉淀碳酸钙的质量计算求得;根据质量守恒定律,反应蒸发水后所得溶液质量=氯化钙溶液质量+碳酸钠溶液质量-生成沉淀的质量-蒸发水的质量.
解答:解:设CaCl2的质量为x,Na2CO3的质量为y,NaCl的质量为z
CaCl2+Na2CO3═2NaCl+CaCO3↓
111 106 117 100
x y z 10g
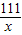 =
=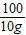
x=11.1g
CaCl2溶液的质量=11.1g÷10%=111g
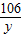 =
= y=10.6g
y=10.6g
Na2CO3溶液的质量=10.6g÷10%=106g
 =
=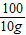 z=11.7g
z=11.7g
所得溶液中溶质的质量分数=
答:所得溶液中溶质的质量分数为10%.
点评:根据化学方程式可以表示反应中各物质的质量比,由反应中某种物质的质量可计算反应中其它物质的质量.
 ×100%,其中氯化钠的质量可根据反应的化学方程式,由生成沉淀碳酸钙的质量计算求得;根据质量守恒定律,反应蒸发水后所得溶液质量=氯化钙溶液质量+碳酸钠溶液质量-生成沉淀的质量-蒸发水的质量.
×100%,其中氯化钠的质量可根据反应的化学方程式,由生成沉淀碳酸钙的质量计算求得;根据质量守恒定律,反应蒸发水后所得溶液质量=氯化钙溶液质量+碳酸钠溶液质量-生成沉淀的质量-蒸发水的质量.解答:解:设CaCl2的质量为x,Na2CO3的质量为y,NaCl的质量为z
CaCl2+Na2CO3═2NaCl+CaCO3↓
111 106 117 100
x y z 10g
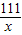 =
=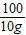
x=11.1g
CaCl2溶液的质量=11.1g÷10%=111g
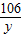 =
= y=10.6g
y=10.6gNa2CO3溶液的质量=10.6g÷10%=106g
 =
=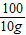 z=11.7g
z=11.7g所得溶液中溶质的质量分数=

答:所得溶液中溶质的质量分数为10%.
点评:根据化学方程式可以表示反应中各物质的质量比,由反应中某种物质的质量可计算反应中其它物质的质量.

练习册系列答案
相关题目

