题目内容
(2012?乐山三模)实验室有半瓶久置的氢氧化钙粉末.某课外活动小组决定对这瓶氢氧化钙粉末的组成进行实验探究.
(1)提出问题:这瓶氢氧化钙是否已经变质,生成碳酸钙.
(2)进行假设、猜想:猜想①氢氧化钙已全部变为碳酸钙; 猜想②氢氧化钙部分变为碳酸钙; 猜想③氢氧化钙没有变质.
(3)设计方案并进行实验:请你选择上述猜想中的任意一种参与探究,并填写下表:
(4)反思与评价:根据你的实验现象和结论,你认为该瓶氢氧化钙
(5)联想与启示:氢氧化钙变质是由于Ca(OH)2与空气中
(1)提出问题:这瓶氢氧化钙是否已经变质,生成碳酸钙.
(2)进行假设、猜想:猜想①氢氧化钙已全部变为碳酸钙; 猜想②氢氧化钙部分变为碳酸钙; 猜想③氢氧化钙没有变质.
(3)设计方案并进行实验:请你选择上述猜想中的任意一种参与探究,并填写下表:
| 实验步骤 | 实验现象 | 实验结论 |
| 取样品粉末,加适量的水,充分搅拌、过滤①取滤液于试管中,滴入酚酞 ②取少量滤渣(或氢氧化钙样品)于试管中,加入盐酸 |
① 不变色 不变色 ② 有气泡 有气泡 |
① 证明固体中无Ca(OH)2 证明固体中无Ca(OH)2 ② 证明固体中有CaCO3 证明固体中有CaCO3 |
全部
全部
(选填“全部”或“部分”或“没有”)变质.(5)联想与启示:氢氧化钙变质是由于Ca(OH)2与空气中
CO2
CO2
(填化学式)发生反应的缘故.因此实验室氢氧化钙应密闭
密闭
保存,农业生产中可用氢氧化钙改良酸
酸
性土壤(选填“酸”或“碱”).分析:(3)氢氧化钙溶于水后溶液呈碱性,可以使酚酞变红,而碳酸钙不溶于水且可与稀盐酸反应放出二氧化碳气体;利用两物质的性质的差异,完成实验探究即可.
(4)由(3)中的实验现象得出相应的结论;
(5)根据氢氧化钙变质的原因和氢氧化钙为碱来进行解答即可.
(4)由(3)中的实验现象得出相应的结论;
(5)根据氢氧化钙变质的原因和氢氧化钙为碱来进行解答即可.
解答:解:(3)根据氢氧化钙溶于水后溶液呈碱性,可以使酚酞变红,而碳酸钙不溶于水且可与稀盐酸反应放出二氧化碳气体的性质可以设计实验如下:取少量粉末溶于一定量水中,过滤,取滤液滴加无色酚酞,根据溶液溶液不变红,说明溶液中没有氢氧化钙;取滤渣滴加稀盐酸,没有有气泡产生,判断滤渣中没有碳酸钙(本题答案具有开放性,根据猜想的不同,实验现象及结论也不同).
(4)根据上述实验现象和结论可以判断该氢氧化钙粉末全部变质;
(5)根据氢氧化钙的性质可以知道,氢氧化钙变质是由于Ca(OH)2与空气中的二氧化碳反应生成了碳酸钙沉淀的缘故,因此为了防止氢氧化钙变质应该在密闭保存;由于氢氧化钙为碱,可以可以用来改良酸性土壤.
故答案为:
(3)
(4)全部;
(5)CO2;密闭;酸性.
(4)根据上述实验现象和结论可以判断该氢氧化钙粉末全部变质;
(5)根据氢氧化钙的性质可以知道,氢氧化钙变质是由于Ca(OH)2与空气中的二氧化碳反应生成了碳酸钙沉淀的缘故,因此为了防止氢氧化钙变质应该在密闭保存;由于氢氧化钙为碱,可以可以用来改良酸性土壤.
故答案为:
(3)
| 实验步骤 | 实验现象 | 实验结论 |
| 取样品粉末,加适量的水,充分搅拌、过滤①取滤液于试管中,滴入酚酞 ②取少量滤渣(或氢氧化钙样品)于试管中,加入盐酸 |
①不变色 ②有气泡 |
①证明固体中无Ca(OH)2 ②证明固体中有CaCO3 |
(5)CO2;密闭;酸性.
点评:本题有一定难度,利用碳酸钙与氢氧化钙溶解性、化学性质的不同,设计实验鉴别两物质是否存在是判断氢氧化钙变质情况的关键.

练习册系列答案
相关题目
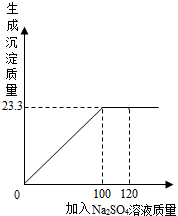 (2012?乐山三模)将24.1g由NaCl和BaCl2组成的固体混合物溶解于99.2mL水 中(P水=1g/cm3),向所得溶液中滴加质量分数为14.2%的Na2SO4溶液,至恰好完全反应.如图是所加Na2SO4溶液质量与生成沉淀质量的关系图,计算:
(2012?乐山三模)将24.1g由NaCl和BaCl2组成的固体混合物溶解于99.2mL水 中(P水=1g/cm3),向所得溶液中滴加质量分数为14.2%的Na2SO4溶液,至恰好完全反应.如图是所加Na2SO4溶液质量与生成沉淀质量的关系图,计算: