题目内容
【题目】如图所示是NaCl和Na2CO3的溶解度曲线。下列叙述不正确的是( )
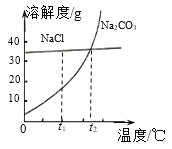
A.t1℃时,20gNaCl放入50g水中,充分搅拌后有固体不溶解
B.t2℃时,NaCl和Na2CO3溶液中所含溶质质量一定相等
C.t1℃时,将NaCl的饱和溶液加热蒸发,一定有晶体析出
D.Na2CO3固体中含有少量的NaCl,可用降温结晶的方法提纯Na2CO3
【答案】B
【解析】
由NaCl和Na2CO3的溶解度曲线图可知,碳酸钠的溶解度随温度的升高而增大,氯化钠的溶解度受温度的影响较小。
A、t1℃时,氯化钠的溶解度小于40g,50g水中溶解的氯化钠的质量小于20g,20gNaCl放入50g水中,充分搅拌后有固体不溶解,故A正确;
B、选项没有指明溶液的质量和状态,t2℃时,等质量的NaCl和Na2CO3的饱和溶液中所含溶质质量才相等,故B不正确;
C、t1℃时,将NaCl的饱和溶液加热蒸发,溶剂减少,一定有晶体析出,故C正确;
D、碳酸钠的溶解度随温度的升高而增大,Na2CO3固体中含有少量的NaCl,可用降温结晶的方法提纯Na2CO3,故D正确。故选B。

 53随堂测系列答案
53随堂测系列答案【题目】碳酸氢钠(NaHCO3)俗名小苏打,常用于食品和医学工业。某化学兴趣小组的同学对碳酸氢钠加热后的产物很感兴趣,对产物进行分析(如图):
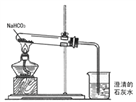
(1)可以看到实验现象有:试管口有小水珠形成,澄清的石灰水变浑浊,得出产物中有
_________、__________。
(2)兴趣小组欲探究白色固体的组成
【提出问题】这白色固体是什么?
【查阅资料】氯化钙溶液呈中性
【提出猜想】
猜想1:白色固体是碳酸钠
猜想2:白色固体是氢氧化钠
猜想3:白色固体是_____________________
【实验探究】
兴趣小组为了确定反应后的固体产物成分,进行了如下实验,请填写下表:
实验方案 | 实验现象 | 结论 |
步骤一:取少量反应后的固体产物溶于水,加入过量的氯化钙溶液,过滤 | 产生白色沉淀 | 猜想1成立 |
步骤二:取滤液少许,往滤液中滴入 ____________________________ | __________________ |
【实验总结】写出碳酸氢钠受热分解的化学方程式:__________________。