题目内容
【题目】某种钾肥样品,其成分为碳酸钾、氯化钾和少量不含钾元素的难溶杂质。为定该钾肥样品中钾元素的含量,进行如下实验:①称取10g该样品溶于水,过滤出去难溶杂质,得到滤液;②在所得滤液中逐滴加入溶质质量分数为10%的稀盐酸,至恰好完全反应时测得所消耗的稀盐酸质量为36.5g;③将反应后的溶液蒸干,称得所得白色固体为10.2g。
请你根据实验数据计算:
(1)样品中碳酸钾的质量;_____
(2)样品中钾元素的质量分数;_____
(3)用pH试纸测定第②步反应后溶液的pH,结果溶液pH大于7,你认为上述实验测得样品中钾元素的质量分数比实际值_____(填“大”、“小”或“不变”)理由是_____。
【答案】6.9g 53.4% 小 蒸干后的固体中含有碳酸钾
【解析】
(1)设样品中碳酸钾的质量为x
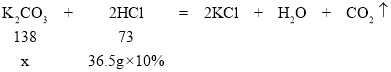
![]() ,x=6.9g,故填:6.9g;
,x=6.9g,故填:6.9g;
(2)由题意知,样品中的钾元素最终都在氯化钾中,最后所得的白色固体10.2g,就是氯化钾的质量。所以钾元素的质量为:10.2g×![]() ×100%≈5.34g,
×100%≈5.34g,
样品中的钾元素质量分数为:![]() ×100%=53.4%,故填:53.4%;
×100%=53.4%,故填:53.4%;
(3)由碳酸钾的溶液呈碱性,所以用pH试纸测定第②步反应后溶液的pH大于7,说明有碳酸钾未完全反应,由于碳酸钾的含钾量比氯化钾的含钾量大,将碳酸钾当成氯化钾时计算出钾的质量要比实际值要小,所以测得样品中钾元素的质量分数也就比实际值要小,故填:小 蒸干后的固体中含有碳酸钾。

 作业辅导系列答案
作业辅导系列答案【题目】某学校化学兴趣小组的同学们在实验室发现一瓶石灰水试剂瓶瓶壁和瓶塞周围有一些白色粉末。为了弄清楚白色粉末的成分及形成原因,他们进行了如下探究:
(提出问题)白色粉末成分的猜想和成因分析。
(做出猜想)①可能是CaCO3:原因是石灰水与空气中的CO2反应。
②可能是___________:原因是溶剂蒸发,石灰水中的溶质结晶析出。
③还可能是Ca(OH)2和CaCO3。
(实验探究)甲同学取白色粉末于试管中,加少量的水、振荡,发现试管底部有白色固体,于是他得出白色粉末是CaCO3的结论。乙同学认为甲同学的结论不严密,理由是______________________。
为了得出较严密的结论,他们进行了下表所示实验,请完成实验报告:
实验步骤 | 实验现象 | 实验结论 |
①取上述试管中的上层清液,滴加1~2滴无色酚酞试液 | 溶液呈红色 | 白色粉末中 ___________________ |
②往上述试管残留的白色固体中加入___________ | ___________ | 白色粉末中含有CaCO3 |
由上述实验可知,白色粉末成分的猜想③是正确的。
(拓展反思)通过上述实验的探究,同学们向实验员提出了保存、使用易变质溶液的下列建议,合理的是_________。
a 密封保存 b 使用前临时配制 c 禁止使用该试剂
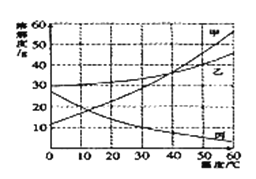
【题目】钙是人体中的常量元素,因缺钙而导致骨质疏松、佝偻病等的患者应在医生的指导下服用钙片。某补钙药剂说明书的部分信息如图1所示。现将100g盐酸分成五等份,逐次加到用40片该药剂制成的粉末中(其他成分不与盐酸反应),得到部分数据与关系图如图2.请根据有关信息回答问题。
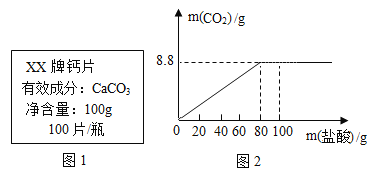
实验次数 | 第一次 | 第三次 | 第四次 |
加入盐酸的质量(g) | 20 | 20 | 20 |
剩余固体的质量(g) | 35 | a | 20 |
(1)该品牌补钙药剂中CaCO3的质量分数是________,a的数值为________。
(2)该盐酸中溶质的质量分数是多少________?(写出计算过程,计算结果精确至0.1%)