题目内容
【题目】据了解,由于各种原因,共享单车的损坏较严重。除了必要的维修之外,较多的损坏车辆,必须进行回收利用以节约资源和保护环境。下图是某厂利用来自于共享单车的合金废料(含Fe、Cu和Al)制取FeSO4和CuSO4溶液的流程示意图(部分生成物已略):
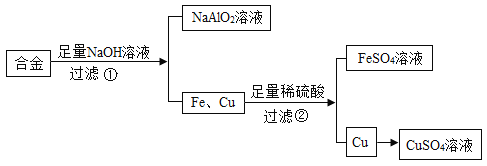
(1)步骤①反应的化学方程式为:2Al+2NaOH+2R═2NaAlO2+3H2↑,R的化学式为___
(2)由Cu制取CuSO4溶液有以下三种途径:
I.Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
Ⅱ.2Cu+O2![]() 2CuO CuO+H2SO4═CuSO4+H2O
2CuO CuO+H2SO4═CuSO4+H2O
Ⅲ.3Cu+8HNO3═3Cu(NO3)+2NO↑+4H2O
从节能环保的角度分析,你认为最佳途径是______,理由是______(任举一点)
(3)在加热条件下,向装有10gCuO的硬质玻璃管中通入H2一段时间,最终玻璃管中剩余固体8.4g.则剩余固体物质中铜元素的质量分数是______。
【答案】H2O II I、III有污染空气的气体产生 95.2%
【解析】
(1)根据质量守恒定律和化学方程式2Al+2NaOH+2R═2NaAlO2+3H2↑,可知:生成物中有2个钠原子,2个铝原子,4个氧原子,6个氢原子,反应物中有2个铝原子,2个钠原子、氢原子、氧原子,所以R是H2O;
(2)通过分析各种途径中的反应物和生成物可知,最佳途径是Ⅱ,理由是:不会生成有毒气体二氧化硫,生成相同质量的硫酸铜,消耗的硫酸少,I、III有污染空气的气体产生;
(3)设参加反应的氧化铜的质量为x,生成铜的质量为y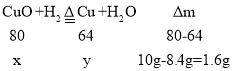
![]() 解得:x=8g y=6.4g
解得:x=8g y=6.4g
则剩余固体物质中铜元素的质量分数是: 。
。

 学业测评一课一测系列答案
学业测评一课一测系列答案【题目】以下是某研究小组探究影响化学反应快慢的一些因素的相关数据(常温通常指20℃;“浓度”指溶质的质量分数)
实验序号 | 过氧化氢溶液浓度/% | 过氧化氢溶液质量/g | 温度/℃ | 二氧化锰用量/g | 氧气体积/mL | 反应所需时间/s |
① | 5 | 12 | 20 | 0.2 | 125 | 11 |
② | 30 | 12 | 20 | 0.2 | 125 | 2 |
③ | 30 | 12 | 40 | / | 125 | 148 |
④ | 30 | 12 | 90 | / | 125 | 82 |
(1)写出实验室用过氧化氢制氧气的文字表达式____________。
(2)通过实验①和②对比可知,化学反应快慢与______有关。
(3)通过对比实验______和______可知,化学反应快慢与温度的关系是______。
(4)由上述实验可知,实验室用过氧化氢制取氧气的最合适的条件是______。