题目内容
核电荷数为1~18的元素的原子结构示意图等信息如下,回答下列问题:

(1)在第二周期中,各原子结构的共同之处是 ;该周期中,各原子核外电子排布的变化规律是 。
(2)在第三周期中,元素类型的变化情况是:从左到右由 元素过渡到 元素,并以稀有气体元素结束。
(3)写出一个核外电子排布与氖原子相同的阳离子:阳离子 。
(4)一般地说,电子层数相同的原子(稀有气体除外),原子的半径随原子序数的递增而减小;最外层电子数相同的原子,原子的半径随电子层数的增加而增大。请比较:氮原子半径 磷原子半径;氧原子半径 氟原子半径。(填“>”或“<”)
【答案】
(1)各原子的电子层数相同 最外层电子数依次递增
(2)金属 非金属 (3)Na+(Mg2+、Al3+) (4)< >
【解析】
试题分析:认真观察第二周期中,各原子的结构示意图不难发现,它们都有2个电子层,该周期中,各原子最外层电子数依次递增;在第三周期中,最左边的是金属元素然后过渡到非金属元素最后以稀有气体氩结束;氖的核外有2个电子层10个电子,失去电子后核外有10个电子的阳离子的原子主要有钠、镁和铝;由于氮和磷的最外层电子数相同且磷是3层,氮是2层,所以磷的原子半径比氮的原子半径大,由于氧和氟的电子层数相同,且氟的原子序数比氧的原子序数大,所以氧的原子半径大于氟的原子半径。
考点:元素周期表。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
核电荷数为1~18的元素中,某微粒结构示意图为: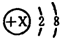 则该微粒( )
则该微粒( )
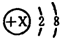 则该微粒( )
则该微粒( )| A、一定是阳离子 | B、一定是阴离子 | C、一定是氖原子 | D、无法确定 |

 ,则该离子带
,则该离子带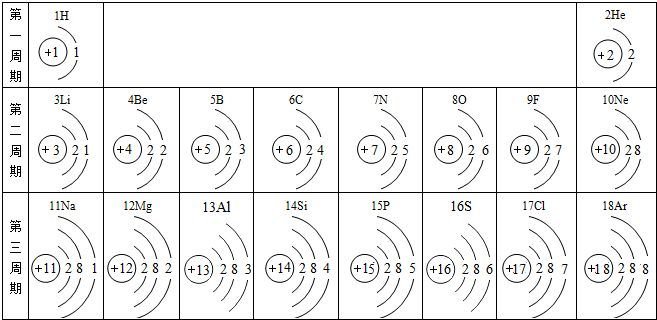 (1)在第二周期中,各原子结构的共同之处是
(1)在第二周期中,各原子结构的共同之处是