题目内容
水蒸气通过灼热的煤所产生的混合气体主要成分为一氧化碳和氢气,还含有二氧化碳和水蒸气,请设计一个实验,以确认混合气中含有一氧化碳和氢气.
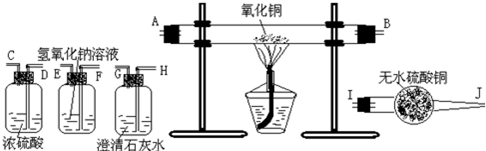
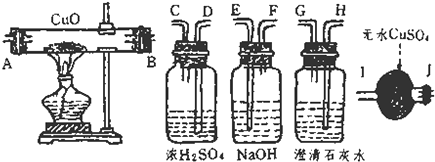
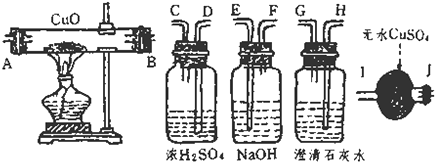
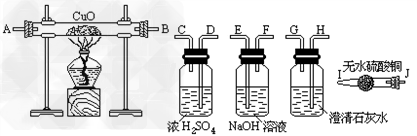
(1)连接上述装置的正确顺序为(填管口字母)混合气→ 接 接 接 接 ;
(2)确认混合气体中有氢气的实验现象是 ,确认理由是 .

(1)连接上述装置的正确顺序为(填管口字母)混合气→
(2)确认混合气体中有氢气的实验现象是
分析:(1)检验气体时,先排除干扰.注意干燥、洗气、检验气体时,气体从“长管进,短管出;
实验过程为:①用氢氧化钠溶液吸收二氧化碳,②用浓硫酸干燥气体,除掉水分,③余下的混合气体进入装有氧化铜的装置,发生还原反应,④充分反应后,气体进入盛有硫酸铜的装置,检验是否有水生成,⑤最后,气体进入澄清石灰水,观察现象,分析解答;
(2)据氢气具有还原性,及氧化铜、铜的颜色,无水硫酸铜遇水变蓝分析解答.
实验过程为:①用氢氧化钠溶液吸收二氧化碳,②用浓硫酸干燥气体,除掉水分,③余下的混合气体进入装有氧化铜的装置,发生还原反应,④充分反应后,气体进入盛有硫酸铜的装置,检验是否有水生成,⑤最后,气体进入澄清石灰水,观察现象,分析解答;
(2)据氢气具有还原性,及氧化铜、铜的颜色,无水硫酸铜遇水变蓝分析解答.
解答:解:(1)由分析可知,为了验证混合气中含有CO和H2,所以实验仪器的连接先后顺序为:除二氧化碳→除掉水分→还原装置→检验水分→检验二氧化碳.①先吸收二氧化碳除掉二氧化碳的干扰;再除掉水分,排除原有水分的干扰;②还原氧化铜以后,先检验水;再检验二氧化碳,此顺序不能颠倒,因为气体从溶液中出来的时候会带来一些水蒸气,影响水的鉴定,气体在通过洗气装置时要长进短出;
(2)因为氢气具有还原性,能和氧化铜反应生成水,水能使无水硫酸铜变蓝,所以确认混合气中含有H2的实验现象是:黑色氧化铜变成红色铜,并且无水硫酸铜变蓝;
故答案为:(1)FE;DC;AB;IJ;HG;
(2)黑色氧化铜变成红色,无水硫酸铜变蓝;H2具有还原性,可与灼热的CuO反应生成铜和水蒸气,无水硫酸铜遇水变蓝.
(2)因为氢气具有还原性,能和氧化铜反应生成水,水能使无水硫酸铜变蓝,所以确认混合气中含有H2的实验现象是:黑色氧化铜变成红色铜,并且无水硫酸铜变蓝;
故答案为:(1)FE;DC;AB;IJ;HG;
(2)黑色氧化铜变成红色,无水硫酸铜变蓝;H2具有还原性,可与灼热的CuO反应生成铜和水蒸气,无水硫酸铜遇水变蓝.
点评:本题主要考查常用气体的检验和除杂方法,要先除杂再据物质的性质检验,了解仪器的装配和连接技巧,掌握氢气和一氧化碳的化学性质才能结合题意灵活解答,能较好考查学生分析、解决问题的能力.

练习册系列答案
相关题目