题目内容
 下图为四种粒子的结构示意图,完成以下填空:
下图为四种粒子的结构示意图,完成以下填空:(1)属于阳离子结构的粒子是
B
B
(填序号);(2)属于金属原子结构示意图的是
C、D
C、D
(同上);(3)某元素R形成的氧化物为R2O3,则R的原子结构示意图可能是
D
D
(同上);(4)写出C单质在A单质中燃烧化学方程式
2Mg+O2
2MgO
| ||
2Mg+O2
2MgO
.
| ||
分析:(1)依据阳离子的特征是核内质子数>核外电子数进行判断;
(2)依据金属原子的最外层电子数一般小于4分析解答即可;
(3)根据氧化物为R2O3来确定R的化合价,并依据元素的最高正价等于该原子的最外层电子数分析解答.
(4)依据两种微粒的质子数确定单质的种类并书写化学方程式;
(2)依据金属原子的最外层电子数一般小于4分析解答即可;
(3)根据氧化物为R2O3来确定R的化合价,并依据元素的最高正价等于该原子的最外层电子数分析解答.
(4)依据两种微粒的质子数确定单质的种类并书写化学方程式;
解答:解:(1)由于阳离子结构是质子数>电子数,观察图示只有B中质子数是12核外电子数是10,所以是阳离子;
(2)由于原子中质子数等于核外电子数,所以观察图示CD为原子,由于金属元素的原子最外层电子数小于4,所以CD均是金属原子的结构示意图;
(3)根据化合价规则,因为氧元素的化合价为-2,所以R元素的化合价为+3,即该原子的最外层电子数为3,所以D符合.
(4)C的质子数是12是镁元素,A的质子数是8是氧元素,所以C单质在A单质中燃烧即是镁在氧气中的燃烧,其化学方程式为:2Mg+O2
2MgO;
故答案为:(1)B;(2)CD;(3)D;(4)2Mg+O2
2MgO;
(2)由于原子中质子数等于核外电子数,所以观察图示CD为原子,由于金属元素的原子最外层电子数小于4,所以CD均是金属原子的结构示意图;
(3)根据化合价规则,因为氧元素的化合价为-2,所以R元素的化合价为+3,即该原子的最外层电子数为3,所以D符合.
(4)C的质子数是12是镁元素,A的质子数是8是氧元素,所以C单质在A单质中燃烧即是镁在氧气中的燃烧,其化学方程式为:2Mg+O2
| ||
故答案为:(1)B;(2)CD;(3)D;(4)2Mg+O2
| ||
点评:本题考查学生对原子结构示意图及其意义的理解,明确元素的概念、粒子中核内质子数和核外电子数之间的关系是解题的关键.

练习册系列答案
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案
相关题目
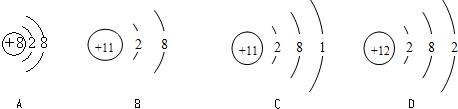

 B
B C
C D
D 