题目内容
【题目】某环保小组监测到一湿法冶铜厂排放的废水中含有硫酸和硫酸铜两种污染物,为测定该废水中各污染物的含量,给冶铜厂提供处理废水的参考,环保小组的同学进行了以下实验。取废水500g,向其中加入溶质质量分数为20%的氢氧化钠溶液。测得沉淀质量与所加入的氢氧化钠溶液的质量关系如图:
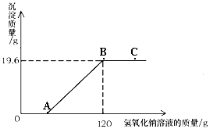
请回答以下问题:
(1)OA段没有产生沉淀的原因是(用化学方程式表示): 。
(2)C点溶液中溶质为
(3)该废水中硫酸铜的溶质质量分数。
(写出计算过程)
【答案】(1)H2SO4+2NaOH= Na2SO4+ 2H2O (2) Na2SO4 、NaOH
(3) 解:设500g废水中CuSO4的质量为χ
CuSO4+2NaOH=Cu(OH)2↓+Na2SO4
160 98
χ 19.6g
160 : 98 =x : 19.6g x=32g
废水中硫酸铜的质量分数为32/500g×100%=6.4%
答:500g该废水中CuSO4的质量分数为6.4%。
【解析】(1) 氢氧化钠先和硫酸反应,(2) C点时,氢氧化钠和硫酸,硫酸铜完全反应,氢氧化钠过量
(3)由图可知氢氧化钠和硫酸铜反应生成的氢氧化铜的质量为19.6g,根据化学方程式列比例式进行解答

练习册系列答案
 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案
相关题目