题目内容
 家庭食用面碱(主要成分为Na2CO3)中往往混有少量NaCl.某课外探究小组的同学为测定食用面碱中碳酸钠的质量分数,设计并进行了以下实验:
家庭食用面碱(主要成分为Na2CO3)中往往混有少量NaCl.某课外探究小组的同学为测定食用面碱中碳酸钠的质量分数,设计并进行了以下实验:
①称取面碱样品11g,全部溶解在100g水中;
②向其中加入CaCl2溶液,至不再生成沉淀为止.
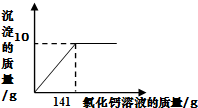
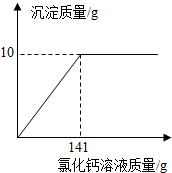
如图是所加CaCl2溶液质量与生成沉淀质量的关系图.
请计算:(计算结果保留一位小数)
(1)食用面碱中Na2CO3的质量分数;
(2)过滤后所得溶液中溶质的质质量分数.
解:设面碱中碳酸钠的质量为x,生成的氯化钠的质量为 y,则
Na2CO3+CaCl2=CaCO3↓+2NaCl
106 100 117
x 10g y
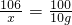
x=10.6g,
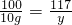
y=11.7g
面碱中碳酸钠的质量分数为: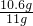 ×100%=96.4%
×100%=96.4%
反应后溶液中氯化钠总质量为:11g-10.6g+11.7g=12.1 g
反应后溶液的质量为:11g+100g+141g-10g=242 g
过滤后所得溶液中溶质的质量分数为: ×100%=5%
×100%=5%
答:(1)食用面碱中Na2CO3的质量分数94.4%;
(2)过滤后所得溶液中溶质的质质量分数5%.
故答案为:(1)96.4%;
(2)5%.
分析:(1)由生成沉淀的质量和样品的质量根据碳酸钠和氯化钙反应的化学方程式可以计算出食用面碱中碳酸钠的质量分数;
(2)根据生成沉淀的质量化学方程式可以计算出生成的氯化钠的质量以及原来样品中氯化钠的质量从而算出过滤后所得溶液中溶质的质质量分数.
点评:本题主要考查含杂质物质的化学方程式计算,难度较大.
Na2CO3+CaCl2=CaCO3↓+2NaCl
106 100 117
x 10g y
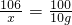
x=10.6g,
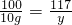
y=11.7g
面碱中碳酸钠的质量分数为:
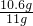 ×100%=96.4%
×100%=96.4%反应后溶液中氯化钠总质量为:11g-10.6g+11.7g=12.1 g
反应后溶液的质量为:11g+100g+141g-10g=242 g
过滤后所得溶液中溶质的质量分数为:
 ×100%=5%
×100%=5%答:(1)食用面碱中Na2CO3的质量分数94.4%;
(2)过滤后所得溶液中溶质的质质量分数5%.
故答案为:(1)96.4%;
(2)5%.
分析:(1)由生成沉淀的质量和样品的质量根据碳酸钠和氯化钙反应的化学方程式可以计算出食用面碱中碳酸钠的质量分数;
(2)根据生成沉淀的质量化学方程式可以计算出生成的氯化钠的质量以及原来样品中氯化钠的质量从而算出过滤后所得溶液中溶质的质质量分数.
点评:本题主要考查含杂质物质的化学方程式计算,难度较大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
 (2012?沙湾区二模)家庭食用面碱(主要成分为Na2CO3)中往往混有少量NaCl.某课外探究小组的同学为测定食用面碱中碳酸钠的质量分数,设计并进行了以下实验:
(2012?沙湾区二模)家庭食用面碱(主要成分为Na2CO3)中往往混有少量NaCl.某课外探究小组的同学为测定食用面碱中碳酸钠的质量分数,设计并进行了以下实验: