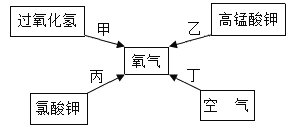
题目内容
【题目】实验室中常用高锰酸钾受热分解制取氧气.
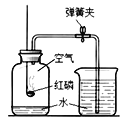
①写出该反应的化学方程式________.
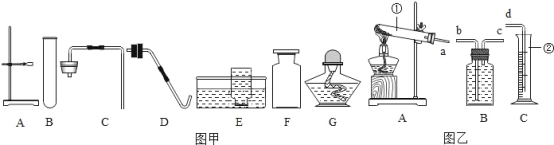
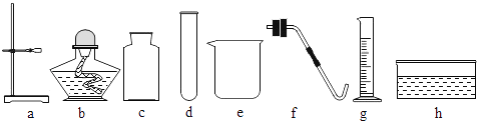
②组装制取氧气装置,从上图中选择所需的仪器有________(填字母序号).
③装置组装完成后,装药品前应首先进行的操作是________.
【答案】2KMnO4![]() K2MnO4+MnO2+O2↑ abcdfh 检查装置的气密性
K2MnO4+MnO2+O2↑ abcdfh 检查装置的气密性
【解析】
①高锰酸钾在加热的条件下分解生成锰酸钾、二氧化锰和氧气,其化学方程式为:2KMnO4![]() K2MnO4+MnO2+O2↑。故填:2KMnO4
K2MnO4+MnO2+O2↑。故填:2KMnO4![]() K2MnO4+MnO2+O2↑。
K2MnO4+MnO2+O2↑。
②用高锰酸钾制取氧气采用的是固体加热型,组装制取氧气装置,从上图中选择所需的仪器有a铁架台,b酒精灯,c集气瓶,d试管,f带胶塞的导管,h水槽。故填:abcdfh。
③装置组装完成后,装药品前应首先进行的操作是检查装置的气密性,防止反应过程中漏气,导致实验失败。故填:检查装置的气密性。

 阅读快车系列答案
阅读快车系列答案【题目】两百多年前,法国化学家拉瓦锡用定量的方法研究了空气成分。仿照这个实验的原理,化学家积极探索、不断创新,设计出下列如图所示的实验装置。
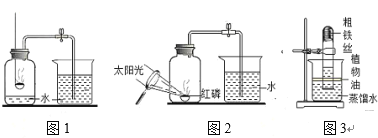
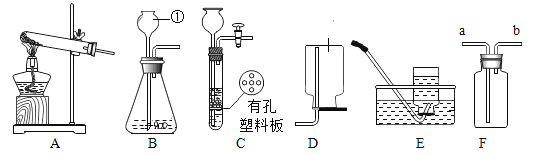
(实验回顾)图1是实验室用红磷燃烧来粗略测定空气中O2含量的装置。
(1)写出红磷燃烧的符号表达式__________。
(2)实验原理:由于红磷燃烧消耗空气中的O2,使容器内外产生__________,烧杯内的水倒吸入集气瓶中,通过量取进入水的体积可以粗略测得空气中O2的含量。
(3)实验结束,发现进入集气瓶中水的体积小于瓶内空气体积的1/5,可能原因是:①实验装置漏气;②__________;③…
(提出问题)测量结果与理论值误差较大,怎样才能减少误差呢?
(查阅资料)
①红磷着火点240℃,白磷着火点40℃;
②磷燃烧后的产物有毒;
③铁在潮湿的空气中会生锈,会消耗氧气。
(实验改进)
(1)甲组同学查阅资料后,对课本上的实验进行了图2所示的改进,其改进后的优点是__________(答一条)
(2)仪器改进后甲组同学测定的实验数据如下:
实验前 | 实验后 | ||
测定项目 | 集气瓶及止水夹左侧导管内空气的总体积 | 烧杯中水的体积 | 烧杯中剩余水的体积 |
体积/ | 126.0 | 80.0 | 54.8 |
根据上述实验可以算出,实验测得空气中O2的体积分数是__________%。
(3)乙组同学根据铁生锈原理,探究用铁能否测定空气中O2的含量,于是用粗铁丝进行了实验(装置如图3)。通过7天测得的数据计算出空气中O2的含量为20.13%。与红磷燃烧的方法相比,该方法的优点是铁丝生锈可以消耗更多的O2,使测量结果更准确,但也存在缺点,你认为缺点是__________。
(拓展延伸)铜也能与空气中氧气、水、二氧化碳反应,生成铜绿[铜绿的主要成分为Cu2(OH)2CO3]。若将图3装置中的粗铁丝换成足量的粗铜丝进行实验,请判断能否比较准确的测定空气中O2含量并说明理由_____________________。