题目内容
【题目】如图装置可用于气体的吸收,检验和分离等,请回答下列问题: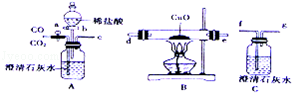
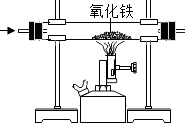
(1)利用装置A(其中液体试剂足量)可以将二氧化碳和一氧化碳的混合气体进行分离,首先打开活塞a,缓缓通入混合气体,广口瓶中观察到的现象是 , 发生反应的化学方程式为;此时从导管c逸出的主要气体是 , 为了检验该气体,将导管按c﹣d﹣e﹣f﹣g顺序连接,B处观察到的现象为 , 发生反应的化学的化学方程式为 .
(2)实验中A和C两处用到澄清石灰水,其中A处澄清石灰水的作用是;
(3)装置C中还应进行的操作是;一段时间后,断开AB装置,关闭活塞a,打开活塞b,滴加足量的稀盐酸,此时逸出的主要气体是 .
(4)现有36.5g质量分数为20%的盐酸与一定质量的氢氧化钙溶液恰好完全反应,生成的氯化钙溶液中溶质的质量分数为22.2%,请计算所得氯化钙溶液的质量.
【答案】
(1)澄清石灰水变浑浊;Ca(OH)2+CO2═CaCO3↓+H2O;一氧化碳;黑色固体变成红色固体;CuO+CO ![]() Cu+CO2
Cu+CO2
(2)吸收二氧化碳气体
(3)把尾气点燃或收集起来;二氧化碳
(4)
解:设生成氯化钙质量为x,
Ca(OH)2+ | 2HCl═ | CaCl2+2H2O |
73 | 111 | |
36.5g×20% | X |
![]() =
= ![]() ,
,
x=11.1g,
所得氯化钙溶液的质量为:11.1g÷22.2%=50g,
答:所得氯化钙溶液的质量为50g.
【解析】解:(1)首先打开活塞a,缓缓通入混合气体,广口瓶中观察到的现象是澄清石灰水变浑浊,是因为氢氧化钙和二氧化碳反应生成了碳酸钙沉淀和水,发生反应的化学方程式为:Ca(OH)2+CO2═CaCO3↓+H2O;
此时从导管c逸出的主要气体是一氧化碳,为了检验该气体,将导管按c﹣d﹣e﹣f﹣g顺序连接,B处观察到的现象为黑色固体变成红色固体,是因为高温条件下,氧化铜和一氧化碳反应生成铜和二氧化碳,发生反应的化学的化学方程式为:CuO+CO ![]() Cu+CO2 .
Cu+CO2 .
故填:澄清石灰水变浑浊;Ca(OH)2+CO2═CaCO3↓+H2O;一氧化碳;黑色固体变成红色固体;CuO+CO ![]() Cu+CO2 . (2)实验中A和C两处用到澄清石灰水,其中A处澄清石灰水的作用是吸收二氧化碳气体.
Cu+CO2 . (2)实验中A和C两处用到澄清石灰水,其中A处澄清石灰水的作用是吸收二氧化碳气体.
故填:吸收二氧化碳气体.(3)装置C中还应进行的操作是处理尾气,方法是把尾气点燃或收集起来;
一段时间后,断开AB装置,关闭活塞a,打开活塞b,滴加足量的稀盐酸,碳酸钙和稀盐酸反应生成二氧化碳,此时逸出的主要气体是二氧化碳.
故填:把尾气点燃或收集起来;二氧化碳.
【考点精析】通过灵活运用二氧化碳的化学性质和一氧化碳的性质,掌握化学性质:一般情况下不能燃烧,也不支持燃烧,不能供给呼吸;与水反应生成碳酸;能使澄清的石灰水变浑浊;与灼热的碳反应;一氧化碳的物理性质:无色,无味的气体,密度比空气略小,难溶于水;一氧化碳的化学性质:可燃性和还原性即可以解答此题.

 课课优能力培优100分系列答案
课课优能力培优100分系列答案 优百分课时互动系列答案
优百分课时互动系列答案