题目内容
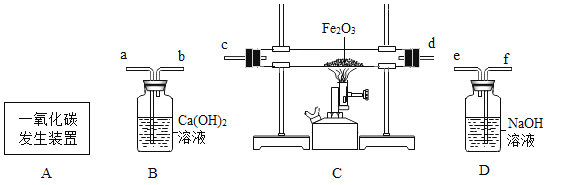
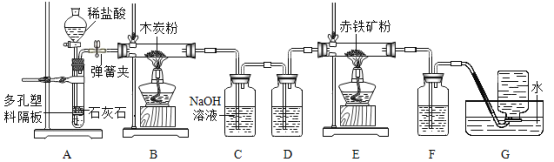
【题目】如图是李龙同学做某些盐的化学性质的四个实验,分析后请回答问题:
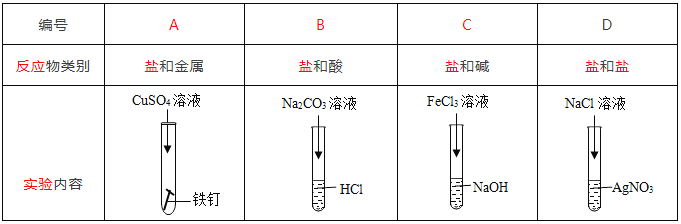
(1)A中反应后溶液中的阳离子一定有__________(填离子符号);
(2)B中反应的现象是_________;
(3)写出C反应的化学方程式______;
(4)D中反应能发生的原因是__________。
【答案】Fe2+ 产生气泡 FeCl3+3NaOH= Fe (OH)3↓+ 3NaCl 交换成分生成沉淀
【解析】
(1)A中铁和硫酸铜反应生成硫酸亚铁和铜,反应后溶液中的阳离子一定有亚铁离子Fe2+;
(2)B中碳酸钠和盐酸反应生成二氧化碳、水、氯化钠,反应的现象是产生气泡;
(3)C反应为氯化铁和氢氧化钠生成氢氧化铁和氯化钠,化学方程为式FeCl3+3NaOH= Fe (OH)3↓+ 3NaCl;
(4)D中氯化钠和硝酸银的反应是复分解反应,反应能发生的原因是生成沉淀(氯化银),符合复分解反应的条件。

【题目】人类的生产、生活离不开水和溶液。
(1)自来水厂净水过程中使用了活性炭,这是因为活性炭具有_________作用。
(2)现有软水和硬水样品各一瓶,请设计实验对它们进行区分,并完成实验报告。
实验步骤 | 实验现象及结论 |
____ | ____ |
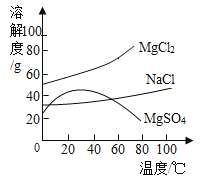
(3)下表是氯化钠、硝酸钾在不同温度时的溶解度。
温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | |
溶解度/g | 氯化钠 | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 | 37.8 | 38.4 |
硝酸钾 | 13.3 | 20.9 | 31.6 | 45.8 | 63.9 | 85.5 | 110 | 138 | 169 | |
下列说法正确的是_________(填字母)。
A 氯化钠的溶解度大于硝酸钾的溶解度
B 20℃时,将30g氯化钠加入50 g水中,充分搅拌,所得溶液中溶质的质量分数为37.5%
C 分别将80℃时硝酸钾的饱和溶液和氯化钠的饱和溶液降温至30℃,析出硝酸钾晶体的质量比析出氯化钠晶体的质量大
D 从含有少量氯化钠的硝酸钾的饱和溶液中得到较多的硝酸钾晶体,通常可采用冷却热饱和溶液的方法
(4)下图是一定溶质质量分数的氯化钠溶液的配制流程。
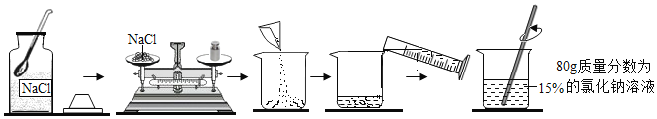
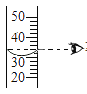
①实验步骤依次为:_________、称量、量取、溶解。用量筒量取所需的水时,若采用仰视的方法读数,配制的氯化钠溶液中溶质的质量分数会_________(填“偏大”或“偏小”)。
②将20g质量分数为6%的氯化钠溶液与30g质量分数为4%的氯化钠溶液充分混合,所得溶液中溶质的质量分数为_________。
(5)在0℃时,氮气的溶解度为0.024。这句话的含义是_______________________。