题目内容
已知A、B分别是盐酸溶液和氢氧化钠溶液中的一种,如图表示向A中逐滴加入B时溶液的pH变化曲线.
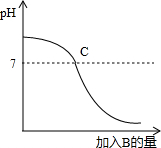
请写出你从曲线中收获的信息.
(1)A是________溶液.
(2)C点表示的意义 是________.
(3)小红同学在验证氢氧化钠能否与稀盐酸反应时,操作如图
| 实验步骤 | 步骤一 | 步骤二 | 步骤三 |
| 操作图示 |  | 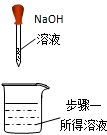 |  |
| 实验现象 | 无明显现象 | 溶液变红 | 溶液红色褪去 |
解:(1)开始时溶液的PH大于7,表明溶液呈碱性,故A是氢氧化钠溶液,所以本题答案为:NaOH;
(2)C点对应的溶液PH为7,表明溶液恰好完全反应,所以本题答案为:盐酸和氢氧化钠恰好反应;
(3)氢氧化钠和盐酸反应时放出热量,此能量来自化学反应,而氢氧化钠固体溶于水放热属于物理变化引起的,所以本题答案为:不相同,盐酸和氢氧化钠反应温度升高是化学反应放热、而氢氧化钠溶于水温度升高是由于水合放热大于扩散吸热的原故.
分析:氢氧化钠溶液呈碱性,其PH大于7,可与盐酸发生中和反应,反应过程中的PH与加入盐酸的量有关系,盐酸少量时PH大于7,恰好完全反应时溶液PH=7,加入盐酸过量则PH小于7,该反应为放热反应.
点评:本题考查了氢氧化钠和盐酸的中和反应,完成此题,可以依据已有的知识进行,要求同学们在平时的学习中加强基础知识的储备.
(2)C点对应的溶液PH为7,表明溶液恰好完全反应,所以本题答案为:盐酸和氢氧化钠恰好反应;
(3)氢氧化钠和盐酸反应时放出热量,此能量来自化学反应,而氢氧化钠固体溶于水放热属于物理变化引起的,所以本题答案为:不相同,盐酸和氢氧化钠反应温度升高是化学反应放热、而氢氧化钠溶于水温度升高是由于水合放热大于扩散吸热的原故.
分析:氢氧化钠溶液呈碱性,其PH大于7,可与盐酸发生中和反应,反应过程中的PH与加入盐酸的量有关系,盐酸少量时PH大于7,恰好完全反应时溶液PH=7,加入盐酸过量则PH小于7,该反应为放热反应.
点评:本题考查了氢氧化钠和盐酸的中和反应,完成此题,可以依据已有的知识进行,要求同学们在平时的学习中加强基础知识的储备.

练习册系列答案
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案
相关题目
 31、已知A、B分别是盐酸溶液和氢氧化钠溶液中的一种,右图表示向A中加入B时,溶液pH变化曲线.请写出你从曲线图中收获的信息:
31、已知A、B分别是盐酸溶液和氢氧化钠溶液中的一种,右图表示向A中加入B时,溶液pH变化曲线.请写出你从曲线图中收获的信息:



 17、已知A、B分别是盐酸溶液和氢氧化钠溶液中的一种,如图表示向A中加入B时,溶液的pH变化曲线.
17、已知A、B分别是盐酸溶液和氢氧化钠溶液中的一种,如图表示向A中加入B时,溶液的pH变化曲线. (2007?北塘区一模)已知A、B分别是盐酸溶液和氢氧化钠溶液中的一种,如图表示向A中逐滴加入B时溶液的PH变化曲线.请写出你从曲线中收获的信息.
(2007?北塘区一模)已知A、B分别是盐酸溶液和氢氧化钠溶液中的一种,如图表示向A中逐滴加入B时溶液的PH变化曲线.请写出你从曲线中收获的信息. 已知A、B分别是盐酸和氢氧化钠溶液中的一种,如图表示向A中加入B时溶液的pH变化曲线.
已知A、B分别是盐酸和氢氧化钠溶液中的一种,如图表示向A中加入B时溶液的pH变化曲线.