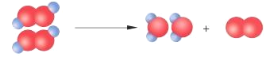
题目内容
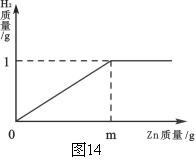
【题目】已知烧杯中装有200g硫酸和硫酸锌混合溶液,其中含硫酸锌12.1g。向烧杯中逐渐加入锌粒,放出气体质量与加入锌粒质量的关系如图14所示。当恰好完全反应时,所得的溶液为不饱和溶液。
请计算:
(1)m的值。
(2)原混合溶液中H2SO4的质量分数。
(3)恰好完全反应时,所得溶液中溶质的质量分数
【答案】
(1)32.5g
(2)24.5%
(3)40%
【解析】恰好完全反应时Zn 、H2SO4的质量分别为m 、x,生成ZnSO4的质量为y。
Zn + H2SO4 = ZnSO4+ H2↑·························1分
65 98 161 2
m x y 1g
(1)m=65×1g÷2=32.5g·························1分
x =98×1g÷2=49g·························0.5分
y=161×1g÷2=80.5g ·························0.5分
(2)H2SO4 的质量分数= ![]() ·························1分
·························1分
(3)恰好完全反应时,所得溶液中ZnSO4的质量分数为:
![]()

【题目】某小组以固态TiO2和气态CCl4为原料在无氧、无水的条件下制取液态TiCl4,反应的化学方程式是:TiO2(固态)+CCl4(气态)═TiCl4(气态)+CO2(气态),实验装置和相关数据如下(熔点和沸点为101.3千帕时测得)。下列分析错误的是
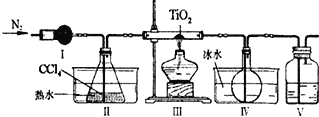
物质 | 熔点 | 沸点 | 其他性质 |
CO2 | -78℃ | -78℃ | 不易溶于CCl4 |
CCl4 | -23℃ | 76℃ | 与TiCl4互溶 |
TiCl4 | -25℃ | 136℃ | 遇潮湿空气产生白雾 |
A. 实验过程中应持续通入氮气
B. 热水的温度不低于76℃
C. 冰水使生成物全部液化
D. 装置V中的试剂为浓硫酸,其作用是防止空气中的水和氧气进入装置
【题目】下列知识归纳,完全正确的一组是( )
A.“三”的小结 | B.环境保护 |
①燃烧必须同时具备:可燃物、氧气、温度达到着火点 ②构成原子的粒子:质子、中子、电子 ③三大化石燃料:氢气、石油、煤 | ①滥用施用化肥和农药 ②重复使用热固性塑料制品 ③工业“三废”处理达标后排放 |
C.数字含义 | D.物质俗名 |
①Fe2+:一个铁离子带2个单位正电荷 ②SO2:一个二氧化硫分子中含有2个原子 ③ | ①固体二氧化碳俗名干冰 ②大理石的主要成分是碳酸钙 ③金属汞俗名水银 |
A. A B. B C. C D. D