题目内容
【题目】海洋中蕴含丰富的资源.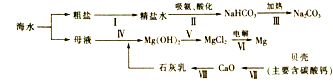
(1)海水淡化是解决淡水资源不足的重要方法.下列方法中,可以使海水变为淡水的是(填字母序号)
A.滤纸过滤
B.吸附
C.沉降
D.蒸馏
(2)从海水中制备纯碱和金属镁的流程如图所示:
回答下列问题:①粗盐水中主要含有CaCl2、MgSO4等可溶性杂质,可先加入稍过量的Ba(OH)2溶液,然后加稍过量的Na2CO3溶液,最后加入适量的(填“硫酸”或“盐酸”),利用过滤等操作除杂得到精盐水;加入Ba(OH)2溶液和Na2CO3溶液顺序能否互换,原因是: , 写出加入Ba(OH)2溶液发生反应的化学方程式: .
②第ⅥⅡ步反应的化学方程式是 .
③上述步骤中,发生了分解反应的是 .
【答案】
(1)D
(2)盐酸;不能,过量的氢氧化钡不能除去;MgSO4+Ba(OH)2=Mg(OH)2↓+BaSO4↓;CaCO3![]() CO2↑+CaO;Ⅳ、Ⅴ
CO2↑+CaO;Ⅳ、Ⅴ
【解析】(1)A、过滤是除去不溶性杂质的方法,不能除去水中的可溶性物质,故错误;B、吸附是除去水中色素、异味等不溶性杂质的一种方法,不能除去水中的氯化钠、氯化镁等可溶性盐,故错误;C、沉降是使大颗粒不容物快速沉淀下来,不能除去水中的可溶性物质,故错误;D、蒸馏是通过加热的方法将水变成水蒸气,再冷凝成水的方法,可以得到最纯的蒸馏水,故可将水淡化,正确;(2)①粗盐水中主要含有CaCl2、MgSO4等可溶性杂质,可先加入稍过量的Ba(OH)2溶液,然后加稍过量的Na2CO3溶液,为了将过量的碳酸钠除去不引入杂质,最后加入适量的盐酸,利用过滤等操作除杂得到精盐水;加入Ba(OH)2溶液和Na2CO3溶液顺序不能互换,原因是过量的氢氧化钡不能除去;加入的Ba(OH)2溶液与硫酸镁发生反应的化学方程式是:MgSO4+Ba(OH)2=Mg(OH)2↓+BaSO4↓.②由题意可知,ⅥⅡ步反应是碳酸钙高温分解,反应化学方程式是:CaCO3![]() CO2↑+CaO.③由流程图可知,上述步骤中Ba(OH)2溶液与硫酸镁发生了反应,氢氧化镁与盐酸发生了中和反应,都属于复分解反应. 故答为:(1)D;①盐酸:不能,过量的氢氧化钡不能除去,MgSO4+Ba(OH)2=Mg(OH)2↓+BaSO4↓.②CaCO3
CO2↑+CaO.③由流程图可知,上述步骤中Ba(OH)2溶液与硫酸镁发生了反应,氢氧化镁与盐酸发生了中和反应,都属于复分解反应. 故答为:(1)D;①盐酸:不能,过量的氢氧化钡不能除去,MgSO4+Ba(OH)2=Mg(OH)2↓+BaSO4↓.②CaCO3![]() CO2↑+CaO.③Ⅳ、Ⅴ.
CO2↑+CaO.③Ⅳ、Ⅴ.
【考点精析】利用水的净化和书写化学方程式、文字表达式、电离方程式对题目进行判断即可得到答案,需要熟知水的净化效果由低到高的是静置、吸附、过滤、蒸馏(均为物理方法),其中净化效果最好的操作是蒸馏;既有过滤作用又有吸附作用的净水剂是活性炭;注意:a、配平 b、条件 c、箭号.

 名校课堂系列答案
名校课堂系列答案