题目内容
【题目】在实验室中可选择下图装置制取气体。
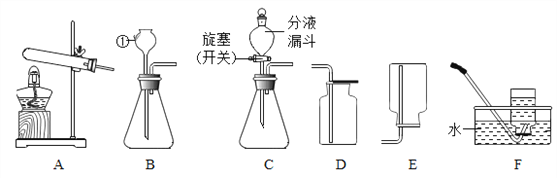
(1)图中标号①的仪器名称是______________。
(2)若选择A、F组合一套装置制取了某气体,请写出有关反应的化学方程式。___________
(3)检查装置B气密性的方法是__________________________。
(4)实验室制取CO2,其发生装置可选择B或C,与B相比较,C的主要优点是什么?______
(5)若用金属与酸反应来制取氢气,应选择以上哪些装置?(写出一套即可)__________
(6)课外小组的同学研究的课题是测定贝壳中碳酸钙的质量分数,他们取25g贝壳粉碎后放入烧杯中,向杯中倒入稀盐酸,当倒入100g稀盐酸后发现不再产生气泡,并测得烧杯内固体和液体总质量为120.6g (杂质不反应)。
①生成二氧化碳的质量是 __________;
②贝壳中碳酸钙的质量分数是______。(写出计算过程)
【答案】 长颈漏斗 2KMnO4 K2MnO4 + MnO2 + O2 ↑ (或 2KClO3 MnO2 2KC1 +3O2 ↑ ) 用止水夹夹紧胶皮管,从长颈漏斗中缓慢加水,若长颈斗颈中能形成一段稳定的水注,说明气密性良好 可通过分液漏斗的开关控制液体的滴加速率和滴加量,来控制反应速率 发生装置选B(或C),收集装置选E(或F) 4.4g 40%
【解析】(1)标号①的仪器名称是长颈漏斗;(2)装置A是固体加热制取气体,而F是排水法收集,所以可以是制取氧气。化学方程式为: ![]()
![]()
![]() 或
或![]()
![]()
![]() ;(3)检查装置B气密性的方法是:用止水夹夹紧胶皮管,关闭止水夹,向长颈漏斗中注水至锥形瓶中的水浸没长颈漏斗末端,继续注入水至长颈漏斗中形成水柱,一段时间后若水柱不下降,即可证明装置不漏气;(4)二氧化碳的发生装置可选择B或C,与B相比较,C的主要优点是:可通过分液漏斗的开关控制液体的滴加速率和滴加量,来控制反应随时发生随时停止;(5)金属与酸反应制取气体,是固体和液体常温下反应,所以发生装置选择B或者C,由于氢气的密度比空气小且难溶于水,所以收集装置为E或者F;(6)根据质量守恒定律可得,生成的二氧化碳的质量为:25g+100g120.6g=4.4g,设贝壳中碳酸钙的质量分数为x,
;(3)检查装置B气密性的方法是:用止水夹夹紧胶皮管,关闭止水夹,向长颈漏斗中注水至锥形瓶中的水浸没长颈漏斗末端,继续注入水至长颈漏斗中形成水柱,一段时间后若水柱不下降,即可证明装置不漏气;(4)二氧化碳的发生装置可选择B或C,与B相比较,C的主要优点是:可通过分液漏斗的开关控制液体的滴加速率和滴加量,来控制反应随时发生随时停止;(5)金属与酸反应制取气体,是固体和液体常温下反应,所以发生装置选择B或者C,由于氢气的密度比空气小且难溶于水,所以收集装置为E或者F;(6)根据质量守恒定律可得,生成的二氧化碳的质量为:25g+100g120.6g=4.4g,设贝壳中碳酸钙的质量分数为x,
![]()
100 44
x 4.4g
![]()
x=10g
所以贝壳中碳酸钙的质量分数为: ![]() 。
。

 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案