题目内容
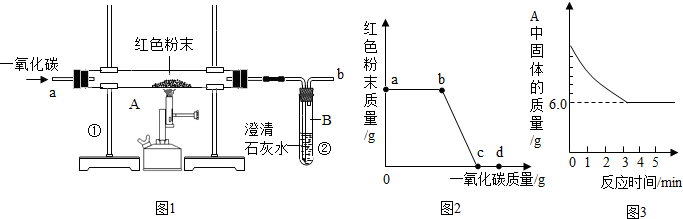
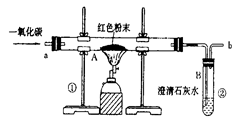
图是炼铁的化学反应原理示意图:( 1)在装置A中先通CO气体的作用是 .
( 2)写出A装置中发生反应的化学方程式 ;实验中观察到A装置中的现象为 .
( 3)为了防止溶液倒吸,本实验停止加热前是否需要先断开A和B的连接处? (填“需要”或“不需要”),理由是 .
( 4 )如何判断反应后硬质玻璃管中生成的物质? .
反思评价:丁同学指出:从环保角度,上图装置有严重不足之处.你认为应该如何改进? .

【答案】分析:(1)根据一氧化碳还原氧化铁的实验步骤及注意事项进行分析解答;
(2)根据一氧化碳可以把氧化铁还原为铁,以及氧化铁和铁粉的颜色分析,并写出化学反应式;
(3)根据玻璃管中气体的压强变化进行分析解答;
(4)物理方法可以利用铁能被磁铁吸引的特点验证;化学方法可以利用铁与稀盐酸反应生成氢气的特点验证.
根据一氧化碳有毒,如果直接排放到空气中,会造成污染,及一氧化碳的可燃性分析尾气处理.
实验步骤是:(1)反应前,先通一段时间一氧化碳,然后再加热(目的是为了尽可能的排净玻璃管内的空气,防止一氧化碳与其中的空气混合后,被点燃发生爆炸).(2)反应后,先撤走并熄灭酒精灯,等固体冷却后再停止通一氧化碳(目的是防止石灰水倒吸到玻璃管内,使其炸裂;也为了使固体冷却,防止刚还原出来的铁再次被氧化).
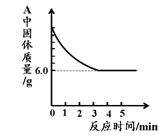
4.实验现象是红棕色的粉末逐渐变为黑色粉末,澄清石灰水逐渐变浑浊(如果点燃尾气,能够燃烧并发出蓝色火焰).
5.尾气处理:由于一氧化碳有毒,如果直接排放到空气中,会造成污染;所以在有关一氧化碳的实验时,都需要注意尾气的处理,常用点燃或收集的方法(如上图所示).
解答:解:(1)根据一氧化碳还原氧化铁实验步骤是及注意事项,反应前,先通一段时间一氧化碳,目的是为了尽可能的排净玻璃管内的空气,防止一氧化碳与其中的空气混合后,被点燃发生爆炸;
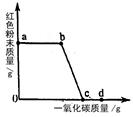
(2)一氧化碳还原氧化铁的方程式为:Fe2O3+3CO 2Fe+3CO2;实验现象为:红色的粉末逐渐变为黑色粉末;
2Fe+3CO2;实验现象为:红色的粉末逐渐变为黑色粉末;
(3)熄灭酒精喷灯会引起试管内温度降低,导致试管内压强骤然减小,B中的水沿导管进入试管,使试管炸裂;为防止溶液倒吸需要先断开A和B的连接处;
(4)判断反应后硬质玻璃管中生成的物质:物理方法可以利用铁能被磁铁吸引的特点验证;化学方法可以利用铁与稀盐酸反应生成氢气的特点验证;
根据一氧化碳有毒,如果直接排放到空气中,会造成污染,及一氧化碳的可燃性分析尾气处理:增加尾气处理装置(点燃或收集的方法);
故答案为:(1)尽可能的排净玻璃管内的空气,防止一氧化碳与其中的空气混合后,被点燃发生爆炸;
(2)Fe2O3+3CO 2Fe+3CO2 ;红色的粉末逐渐变为黑色粉末;
2Fe+3CO2 ;红色的粉末逐渐变为黑色粉末;
(3)需要;防止因熄灭酒精喷灯而引起试管内温度降低,导致试管内压强骤然减小,B中的水沿导管进入试管,使试管炸裂;
(4)物理方法:利用铁能被磁铁吸引的特点验证;化学方法:利用铁与稀盐酸反应生成氢气的特点验证;
增加尾气处理装置(点燃或收集的方法).
点评:本题通过一氧化碳还原氧化铁的化学反应让同学们了解炼铁的原理,通过对反应前后物质的变化来判断现象以及对最后的环境污染物进行处理,是同学们应掌握的基本技能.
(2)根据一氧化碳可以把氧化铁还原为铁,以及氧化铁和铁粉的颜色分析,并写出化学反应式;
(3)根据玻璃管中气体的压强变化进行分析解答;
(4)物理方法可以利用铁能被磁铁吸引的特点验证;化学方法可以利用铁与稀盐酸反应生成氢气的特点验证.
根据一氧化碳有毒,如果直接排放到空气中,会造成污染,及一氧化碳的可燃性分析尾气处理.
实验步骤是:(1)反应前,先通一段时间一氧化碳,然后再加热(目的是为了尽可能的排净玻璃管内的空气,防止一氧化碳与其中的空气混合后,被点燃发生爆炸).(2)反应后,先撤走并熄灭酒精灯,等固体冷却后再停止通一氧化碳(目的是防止石灰水倒吸到玻璃管内,使其炸裂;也为了使固体冷却,防止刚还原出来的铁再次被氧化).
4.实验现象是红棕色的粉末逐渐变为黑色粉末,澄清石灰水逐渐变浑浊(如果点燃尾气,能够燃烧并发出蓝色火焰).
5.尾气处理:由于一氧化碳有毒,如果直接排放到空气中,会造成污染;所以在有关一氧化碳的实验时,都需要注意尾气的处理,常用点燃或收集的方法(如上图所示).
解答:解:(1)根据一氧化碳还原氧化铁实验步骤是及注意事项,反应前,先通一段时间一氧化碳,目的是为了尽可能的排净玻璃管内的空气,防止一氧化碳与其中的空气混合后,被点燃发生爆炸;
(2)一氧化碳还原氧化铁的方程式为:Fe2O3+3CO
 2Fe+3CO2;实验现象为:红色的粉末逐渐变为黑色粉末;
2Fe+3CO2;实验现象为:红色的粉末逐渐变为黑色粉末;(3)熄灭酒精喷灯会引起试管内温度降低,导致试管内压强骤然减小,B中的水沿导管进入试管,使试管炸裂;为防止溶液倒吸需要先断开A和B的连接处;
(4)判断反应后硬质玻璃管中生成的物质:物理方法可以利用铁能被磁铁吸引的特点验证;化学方法可以利用铁与稀盐酸反应生成氢气的特点验证;
根据一氧化碳有毒,如果直接排放到空气中,会造成污染,及一氧化碳的可燃性分析尾气处理:增加尾气处理装置(点燃或收集的方法);
故答案为:(1)尽可能的排净玻璃管内的空气,防止一氧化碳与其中的空气混合后,被点燃发生爆炸;
(2)Fe2O3+3CO
 2Fe+3CO2 ;红色的粉末逐渐变为黑色粉末;
2Fe+3CO2 ;红色的粉末逐渐变为黑色粉末;(3)需要;防止因熄灭酒精喷灯而引起试管内温度降低,导致试管内压强骤然减小,B中的水沿导管进入试管,使试管炸裂;
(4)物理方法:利用铁能被磁铁吸引的特点验证;化学方法:利用铁与稀盐酸反应生成氢气的特点验证;
增加尾气处理装置(点燃或收集的方法).
点评:本题通过一氧化碳还原氧化铁的化学反应让同学们了解炼铁的原理,通过对反应前后物质的变化来判断现象以及对最后的环境污染物进行处理,是同学们应掌握的基本技能.

练习册系列答案
 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案
相关题目
 钢铁是使用最多的金属材料.
钢铁是使用最多的金属材料.